高二选修4化学反应原理
化学反应和能量变化
[强调]
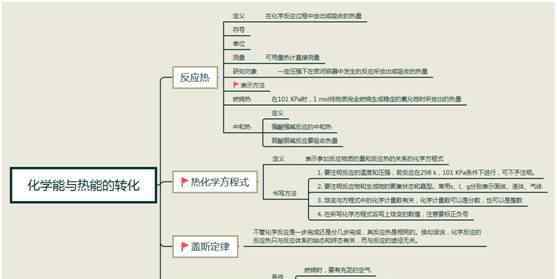
1.古斯定律
2.写热化学方程
1)1含义
热化学方程不仅显示了化学反应中物质的变化,还显示了化学反应中能量的变化。
2)写热化学方程的4个注意事项
(2)值、符号和单位。
③系数可以是整数,也可以是分数。
④系数加倍,数值加倍,反作用,符号变,绝对值不变。
[困难]
热化学方程的书写
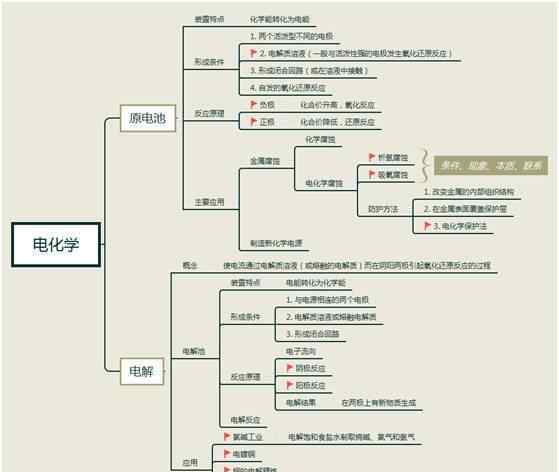
电解池、原电池
[强调]
1.一次电池的工作原理及电极方程的编写。
2.电解池的工作原理及电极方程的编写。
3.电解池的应用。
2)负离子放电顺序:
①惰性电极:
②活性电极:电极本身溶解并放电
注意电极材料是惰性电极还是活性电极。如果阳极材料是金属如活性电极(Fe,Cu),阳极反应是电极材料失去电子变成离子进入溶液;如果是惰性物质,电极反应公式会根据阴阳离子的放电顺序和阳氧阴返定律来写。
2.电解质水溶液的电解产物定律
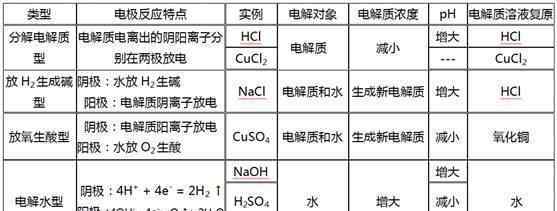
上述四种电解质的分类:
1)电解水类型:含氧酸、强碱和活性金属含氧酸盐
2)电解质类型:无氧酸、不活泼金属的无氧酸盐(氟化物除外)
3)析氢和产碱:活性金属的无氧酸式盐
4)氧酸型:非活性金属的氧酸盐
3.燃料电池电极方程的写作技巧
1)电池负极必须是可燃气体,失去电子,元素化合价升高,产生氧化反应。电池的正极必须是助燃气体,助燃气体获得电子,价态降低,产生还原反应。
2)燃料电池的两个电极的材料一般不参与反应,而是与通入电机的燃料和氧气反应,两个电极只传导电子。
3)电极反应作为一个特殊的离子反应方程,也必须遵循原子守恒、得失守恒、电子守恒和电荷守恒
4)写电极反应时电解液是什么?其中离子应该对应电极反应中出现的离子。在碱性电解液中,氢离子不能出现在酸性电解液中,氢氧根离子不能出现在电极反应式中
5)正负电极的电极反应是在得失电子守恒的条件下,叠加的电池反应一定是燃料燃烧反应和燃料产物与电解质溶液反应的叠加反应式。
出现频率高的甲烷燃料电池;
(1)碱性介质阴极:
正极:
总反应:
(2)酸性介质阴极:
正极:
总反应:
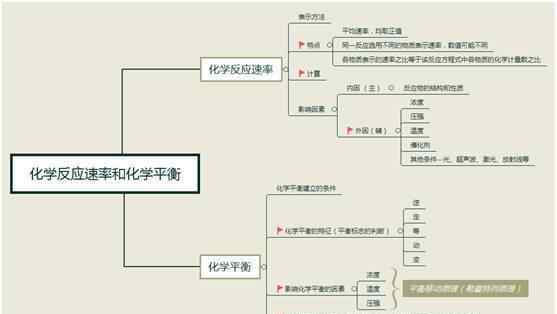
化学反应的方向、极限和速率
[强调]
1.对化学平衡概念的理解
可逆反应是有限的,所有的转化都是不完全的。
如果正向和反向速率相等,则存在化学平衡状态。
此时反应并没有停止,特征是动态的、恒定的。
2.化学平衡状态的判断
逆等速恒变平衡,第一类,第二类,第六类,相等的正向和反向反应速率,以及第二种生产转化率的最大平衡。
质量-体积n分数,浓度-温度颜色不变,参数可以变也可以不变(变量不变),要记住固定的平衡,参数不变,不能用来打破平衡。
解释一下:
“逆等速恒变平衡”是指平衡态具有逆、等速、恒、变五个特征。
“一级”是指反应体系中同一反应物(或产物)的正向和反向反应速率相等,即达到平衡状态。"
“两个最大值”是指转化率和产率达到最大值,达到平衡状态。
“六个确定性”是指体系中各组分的质量分数、体积分数、质量分数和浓度不再发生变化,或者体系的温度和颜色不再发生变化,从而达到平衡状态。
“参数可以变常数,平衡必须记得清楚”是指参数(浓度、温度、质量、压力、体积、密度等。)最初是变量,然后变成常数,这时可逆反应达到平衡。
“参数不变、不可用、失衡”是指如果参数在反应过程中始终不变,则不能用这个参数来判断可逆反应是否处于平衡状态
3.顺差
(1)“活性平衡”是指在相同条件下,在同一可逆反应中建立的两个或两个以上的化学平衡,其中所有相同物质的百分比相同,这些化学平衡属于活性平衡,其核心是“所有相同物质的百分比相同”。
②“主动平衡”有两种常见情况:恒温恒压和恒温定容,可以概括为:等压比;等容等于等容,但如果系统(气体系数)不变,则比值可以等于[前提下的三种情况:等t】。
4.化学反应速率、平衡转化率和化学平衡常数的计算
[困难]
1.化学反应速率和化学平衡图像
(1)比率和余额的图像分析
1)识别坐标系,找出纵横坐标所代表的含义,并与相关原理联系起来。
2)看清出发点,分清反应物和产物。浓度降低的是反应物,浓度升高的是产物。
3)把握变化趋势,区分正面和负面反应。区分吸热反应和放热反应。区分渐变和突变。随着温度的升高,V(吸收)>:V,在速率-时间图上,注意看曲线是连续的还是跳跃的。
4)注意终点。比如在浓度-时间图上,一定要看清终点反应物的消耗和产物的增加,并根据相关原理进行推理判断。
(2)对于可逆反应:(正反应是放热的)
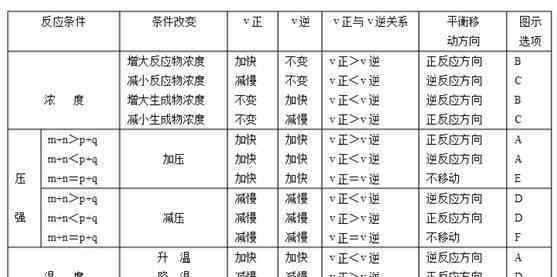
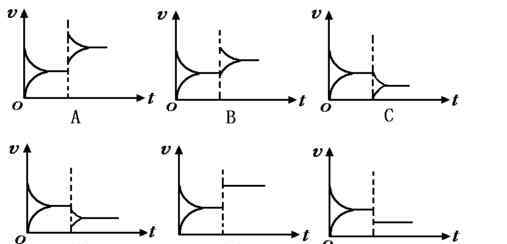
速率和平衡图像记忆公式:
浓度:浓度升高浓度降低,变化是突然的,不是渐进的;
压力:增压增加,变化最大,减压减少,变化最大;
温度:温度升高,吸热变化大,温度降低,吸热变化小;
催化剂:催化剂不增加,阻力减小,天平不动,时间改变。
掌握了重点难点和考点的方法,为什么一般情况下会害怕认可那个问题?如果融入其他话题,可以顺利解决~
~
1.《高二化学反应原理 【高二化学】化学反应原理知识框架+重难点总结!》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《高二化学反应原理 【高二化学】化学反应原理知识框架+重难点总结!》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/fangchan/1627473.html