
文/江宁 特约撰稿员正文/江宁特约撰稿人
7月28日,陈伟院士在天津举行的一次活动中,就人类腺病毒载体疫苗Ad5-nCo研制过程中面临的问题做了内部报告,这是对疫苗研制全过程的第一次全面解读,回应了公众对疫苗高副作用的质疑。这份内部报告发生在Consino即将上市的前夕。


该疫苗于3月16日获得批准,当晚第一名受试者接种了疫苗。那一天,世界上只有两种疫苗,一种是我们的重组腺病毒疫苗,另一种是美国马德纳公司的mRNA疫苗。我们提前了五个小时。重组腺病毒疫苗是北京时间3月16日,马德纳公司是美国时间3月16日。
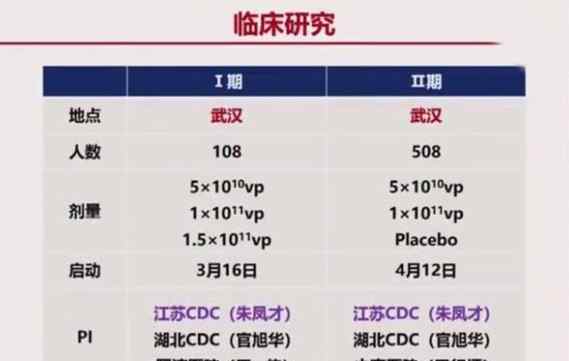
武汉一期临床试验108人。二期临床试验于4月12日开始,共接种508人。这是唯一一种一针见效的疫苗。


3月16日在武汉、Xi、北京举行远程答疑,获得临床许可。

5月22日,重组腺病毒疫苗一期临床结果发表在《柳叶刀》上。

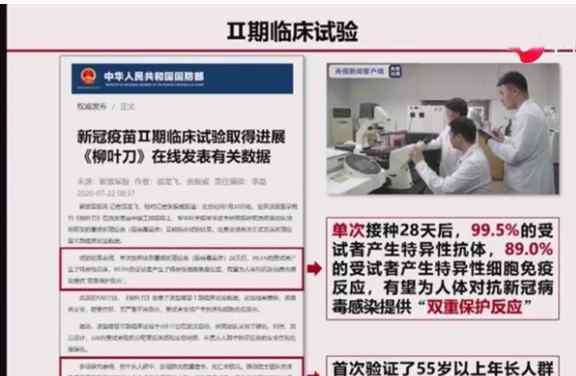
7月20日,一篇关于冠状病毒疫苗二期临床试验结果的论文在《柳叶刀》上发表,表明该疫苗安全,可诱导免疫应答。
必须强调的是,上述临床试验中的受试者在接种疫苗后并未被故意暴露于冠病风险,疫苗是否能有效预防冠病感染仍不确定,但需要三期临床试验来回答这个问题。此外,受试者仅随访28天,因此没有该疫苗诱导免疫持久性的数据。
前述二期临床试验的主要目的是评价疫苗的免疫原性和安全性,为确定三期临床试验中最合适的疫苗剂量提供依据。
以上测试于4月份在武汉进行。涉及508名受试者。13%的受试者年龄超过55岁。61%的受试者年龄在18至44岁之间,26%的受试者年龄在45至54岁之间。其中,253名受试者接种了高剂量疫苗。126人接受了没有接种疫苗的安慰剂。结果表明,接种上述疫苗的高剂量组95%的受试者和低剂量组91%的受试者在接种后第28天诱导了T细胞免疫应答或抗体免疫应答。
此外,接种后第28天,高剂量组96%的受试者和低剂量组97%的受试者表现出抗体结合免疫应答。然而,具有中和抗体免疫应答的受试者的比例分别为59%和47%。
Lancet的论文认为,腺病毒重组疫苗,就不良反应而言,接种后28天内,高剂量组共有24名受试者出现三级严重不良反应,占9%;低剂量组1人;安慰剂组2人;主要症状是发烧。大多数受试者的不良反应为轻度或中度,如发热、疲劳和注射部位疼痛。高剂量组有72%的受试者有上述症状,低剂量组有74%,安慰剂组有37%。

目前,我们正在与俄罗斯、巴西、智利和沙特阿拉伯就第三阶段试验进行谈判,预计第三阶段试验将于8月份进行。
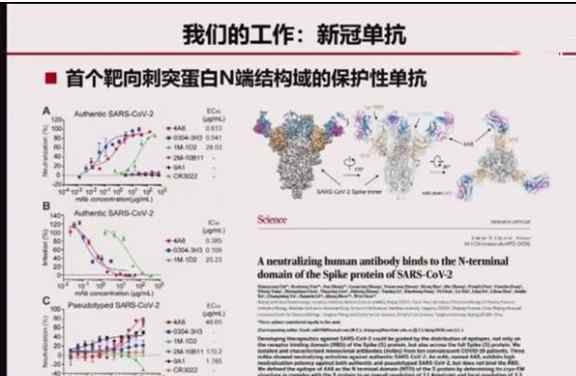
陈院士团队目前正在研究单克隆抗体。
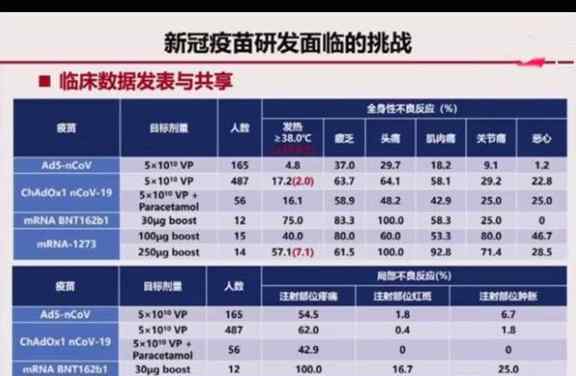

关于重组腺病毒疫苗的副作用和安全性,陈伟院士透露,5月22日我们发表第一份报告时,压力很大,说疫苗副作用大,发热率高。造成这个问题的原因是:一是国内外发热标准不一致。目前国外认为发热38度以上,国内认为发热37度。如果以国外38度为标准,我们的目标发热率只有4.8%,疲劳、头痛、肌肉痛、恶心等症状都低于其他已公布数据的疫苗。无论是全身反应还是局部反应,都比其他疫苗的数据弱很多,都是基于数据。
1.《陈薇院士回应疫苗发热率高 事件的真相是什么?》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《陈薇院士回应疫苗发热率高 事件的真相是什么?》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/jiaoyu/1019553.html

