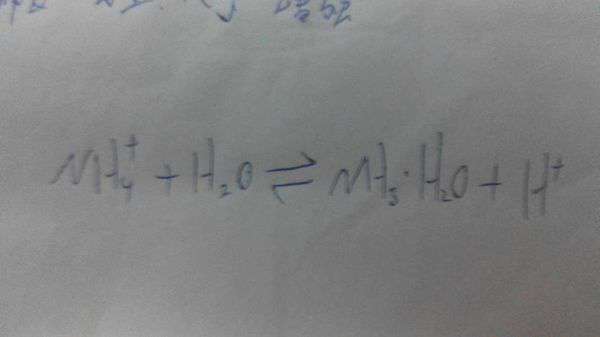想要学好化学,化学方程式一定要记牢,下面是小编整理的必修一的化学方程式,赶快收藏吧!

1、钠在空气中燃烧(黄色的火焰)
2Na + O2==【点燃】Na2O2
钠块在空气中变暗
4Na+O2=2Na2O
Na2O在空气中加热(变黄)
2Na2O+O2=2Na2O2
2、钠与水反应(浮、熔、游、响、红)
2Na + 2H2O = 2H2O + H2 ↑
2Na + 2H2O = 2Na + 2OH- + H2↑
3、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)
2Na2O2 + 2H2O = 4NaOH + O2 ↑
2Na2O2 + 2H2O = 4Na +4OH -+O2↑
碱性氧化物Na2O与水的反应
Na2O+H2O=2NaOH
4、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:
2Na2O2 + 2CO2 = 2Na2CO3 + O2
5、苏打(纯碱)与盐酸反应
①盐酸中滴加纯碱溶液
Na2CO3 + 2HCl = 2NaCl + H2O+CO2↑
CO32- + 2H+ = H2O + CO2↑
②纯碱溶液中滴加盐酸,至过量
Na2CO3 + HCl =NaHCO3 + NaCl
CO32- + H = HCO3-
NaHCO3+HCl=NaCl+H2O+CO2↑
HCO3-+H = H2O +CO2↑
6、小苏打受热分解
2NaHCO3==【加热】Na2CO3 + H2O +CO2 ↑
7、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热
NaHCO3 + NaOH==【加热】Na2CO3 + H2O
HCO3-+ OH - = H2O + CO32-
(若是溶液中反应有离子方程式)
8、金属锂在空气中燃烧
4Li + O2==【加热】2Li2O
9、氯气的性质
铜丝在氯气中剧烈燃烧(棕色烟)
Cu + Cl2==【点燃】CuCl2
之后加水,可由绿色溶液(浓)得到蓝色溶液(稀)
Cl2 +2FeCl2 =2FeCl3
2Cl2+2NaBr=2NaCl+Br2
Cl2 +2NaI =2NaCl+I2
Cl2+SO2 +2H2O=H2SO4 +2HCl
2Na + Cl2 ==【点燃】2NaCl
10、铁在氯气中剧烈燃烧 2Fe +3Cl2==【点燃】3FeCl3
11、氢气在氯气中燃烧(苍白色火焰)
H2 + Cl2==【点燃】2HCl
氟气与氢气反应(黑暗处即可爆炸)
H2+F2=2HF
12、氯气溶于水(新制氯水中含H+ 、Cl-、ClO-、OH-、Cl2、HClO、H2O)
Cl2 + H2O = HCl + HClO
Cl2 + H2O = H+ + Cl- + HClO
13、次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂)
2HClO==【光照】2HCl + O2↑
14、工业制漂白粉的原理及漂白粉的失效
2Ca(OH)2 + 2Cl2 =Ca(ClO)2 + CaCl2 +2H2O
2Ca(OH)2 +2Cl2 =2Ca2++2ClO-+2Cl-+2H2O
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
2HClO==【光照】 2HCl + O2↑
Ca2-+2ClO-+ CO2 + H2O =CaCO3↓+ 2HClO
15、氯气的实验室制法:(仪器:分液漏斗,圆底烧瓶)
MnO2 +4HCl(浓)==【加热】 MnCl2+Cl2↑+2H2O
MnO2 +4H++2Cl-==【加热】Mn2++Cl2↑+2H2O
16、新制氯水注入盛溴化钠溶液的试管中
Cl2 + 2NaBr = Br2 + 2NaCl
Cl2 + 2Br- = Br2 + 2Cl-
17、铁与硫加热反应 Fe + S==【加热】FeS
铁与氧气加热反应 3Fe+2O2==【加热】Fe3O4
铁在氯气中加热反应 2Fe+3Cl2==【加热】2FeCl3
18、铜与浓硫酸反应: Cu+2H2SO4 (浓) ==【加热】CuSO4 +2H2O+SO2 ↑
19、碳与浓硫酸反应: C+2H2SO4(浓)==【加热】2H2O+CO2↑+2SO2↑
20、工业制单质硅(碳在高温下还原二氧化硅)
SiO2 + 2C=(高温)Si + 2CO↑
21、二氧化硅与氢氧化钠反应
SiO2 + 2NaOH = Na2SiO3 + H2O
SiO2 + 2OH = SiO32- + H2O
22、氮气和氢气反应(工业合成氨)
N2 + 3H2→【催化剂】 2NH3
2NH3→【高温高压】N2 + 3H2
23、氮气和氧气放电下反应(雷雨发庄稼)
N2 + O2=(放电)2NO
2NO + O2=2NO2
二氧化氮溶于水
3NO2 + H2O =2HNO3 + NO
3NO2 + H2O =2H + 2NO3-+NO
24、HNO3与Fe的反应
Al、Fe遇浓HNO3、浓硫酸钝化(常温)
Fe与浓HNO3加热
Fe+6HNO3==【加热】 Fe(NO3)3+3NO2↑+3H2O
Fe与稀HNO3反应
Fe+4HNO3=Fe(NO3)3+NO↑+2H2O
3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O
25、NO2 、O2 的混合气通入水中无剩余气体
4NO2 + O2 + 2H2O = 4 HNO3
26、NO 、O2 的混合气通入水中无剩余气体
4NO + 3O2 + 2H2O = 4 HNO3
27. 氨的催化氧化
4NH3 +5O2 ==【催化剂、加热】4NO + 6H2O
28. 碳酸氢铵受热分解
NH4HCO3==【加热】 NH3 ↑+ H2O↑ + CO2↑
29. 用浓盐酸检验氨气(白烟生成)
HCl + NH3 = NH4Cl
30. 硫酸铵溶液与氢氧化钠溶液混合加
(NH4)2SO4 +2NaOH==【加热】2NH3↑+Na2SO2 +2H2O
NH4+ + OH-==【加热】NH3 ↑+ H2O
31. 硝酸铵溶液与氢氧化钠溶液混合(不加热)
NH4NO3 + NaOH = NH3·H2O + NaNO3
NH4+ + OH- = NH3·H2O
32. 铝箔在氧气中剧烈燃烧
4Al + 3O2 ==2Al2O3
33. 铝片与稀盐酸反应
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al + 6H+ = 2Al3+ +3H2↑
34. 铝与氢氧化钠溶液反应
2Al+2NaOH +2H2O = 2NaAlO2 +3H2↑
2Al + 2OH- +2H2O = 2AlO2- + 3H2↑
35. 铝与三氧化二铁高温下反应(铝热反应)
2Al + Fe2O3==【高温】 2Fe + Al2O3
36. 镁在二氧化碳中燃烧
2Mg + CO2 ==【点燃】2MgO + C
37. 氧化铝溶于氢氧化钠溶液
Al2O3 + 2NaOH = 2NaAlO2 +H2O
Al2O3 + 2OH- = 2AlO2- + H2O
38. 硫酸铝溶液中滴过量氨水
Al2(SO4)3 +6NH3·H2O=2Al(OH)3↓+(NH4)2SO4
Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+
39. ①氢氧化铝溶液中加盐酸
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
②Al(OH)3与NaOH溶液反应
Al(OH)3 + NaOH = NaAlO2 +2 H2O
Al(OH)3 + OH- = AlO2- +2 H2O
40. 高温下铁与水反应
3Fe + 4H2O(g)==【高温】 Fe3O4 + 4H2
41. 铁与盐酸反应
Fe + 2HCl = FeCl2 + H2↑
Fe + 2H+ = Fe2+ + H2↑
42. 氧化铁溶于盐酸中
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 + 6H+ = 2Fe3+ + 3H2O
43. 氯化铁中滴入氢氧化钠溶液(红褐色沉淀)
FeCl3 + 3NaOH = Fe(OH)3 ↓+3NaCl
Fe3+ + 3OH- = Fe(OH)3 ↓
44. 氢氧化亚铁在空气中被氧化(白色沉淀变为红褐色沉淀)
4Fe (OH)2 + O2 + 2H2O = 4Fe (OH)3
45. 氯化亚铁溶液中通入氯气
2FeCl2 + Cl2 = 2FeCl3
2 Fe2+ + Cl2 = 2 Fe3+ + 2Cl-
46. 氯化铁溶液中加入铁粉
2FeCl3 + Fe =3FeCl2
2Fe3++ Fe = 3Fe2+
47. 用KSCN检验的存在离子方程式
Fe3+ 3SCN-= Fe(SCN)3
1.《na2o 高一化学必修一方程式总结》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《na2o 高一化学必修一方程式总结》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/jiaoyu/541502.html