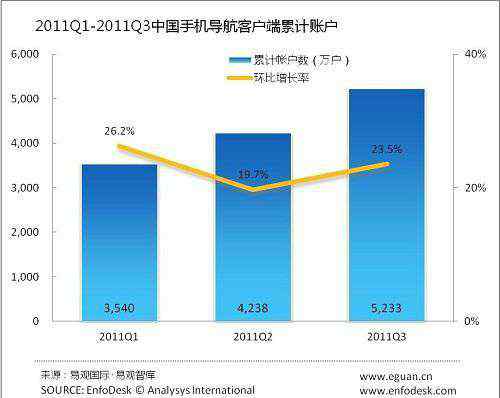
一、证明性文件:
1.《进口兽药注册证书》或者《兽药注册证书》原件及农业部批准有关变更注册批件的复印件;
2.兽药生产国或地区兽药管理机构出具的允许该兽药上市销售及该兽药生产企业符合《兽药生产质量管理规范》的证明文件、公证文书及其中文译本;
3.兽药生产国或地区兽药管理机构允许兽药进行变更的证明文件、公证文书及其中文译本;
4.由境外制药厂商常驻中国代表机构办理注册事务的,应当提供《外国企业常驻中国代表机构登记证》复印件;
5.境外制药厂商委托中国代理机构代理申报的,应当提供委托文书、公证文书及其中文译本,以及中国代理机构的《营业执照》复印件。
二、5年内在中国进口、销售情况的总结报告,对于不合格情况应当作出说明。
三、兽药进口销售5年来临床使用及不良反应情况的总结报告。
四、再注册兽药有下列情形的,应当提供相应资料或者说明:
1.需要进行IV期临床试验的,应当提供IV期临床试验总结报告;
2.兽药批准证明文件或者再注册批准文件中要求继续完成工作的,应当提供工作总结报告,并附相应资料。
五、提供兽药处方、生产工艺、兽药标准和检验方法。凡兽药处方、生产工艺、兽药标准和检验方法与上次注册内容有改变的,应当指出具体改变内容,并提供批准证明文件。并按照兽药变更注册事项中的相关要求提供资料,进行变更注册申请。
六、生产兽药制剂所用原料药的来源。改变原料药来源的,应当提供批准证明文件,并按照兽药变更注册事项中的相关要求提供资料,进行变更注册申请。
七、在中国市场销售兽药最小销售单元的包装、标签和说明书实样。
八、兽药生产国或地区兽药管理机构批准的现行说明书原文及其中文译本。如改变已批准的标签说明书中安全性内容或样式,应进行变更注册申请,并提供相应资料。
1.《进口兽药 进口兽药再注册申报资料项目(农业部公告第442号发布)》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《进口兽药 进口兽药再注册申报资料项目(农业部公告第442号发布)》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/junshi/475205.html