溶液中溶质质量分数的计算,是初中化学相对较难的题型,但是其实只要记住溶质的质量分数的计算公式,准确分析出题目中的溶质、溶液的质量,代入公式,这类问题就能够迎刃而解!
溶液中溶质质量分数的计算,是初中化学相对较难的题型,但是其实只要记住溶质的质量分数的计算公式,准确分析出题目中的溶质、溶液的质量,代入公式,这类问题就能够迎刃而解!
一
溶质质量分数的计算基本公式
一
溶质质量分数的计算基本公式
1、溶质的质量分数:是溶质质量与溶液质量之比。
2、基本公式
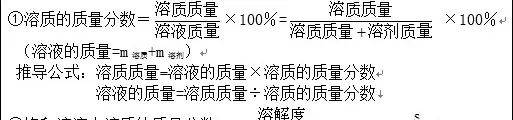
溶液的质量=溶液的密度×溶液的体积
溶质质量=溶液密度×溶液体积×溶质质量分数
3、溶液稀释公式
m1ω1=m2ω2或ρ1V1ω1=ρ2V2ω2
(稀释前溶液质量×稀释前溶质质量分数=稀释后溶液质量×稀释后溶质质量分数)
注意牢牢抓住:稀释前溶质质量=稀释后溶质质量
(所加水的质量=稀释后溶液质量-稀释前溶液质量)
二
有关溶质的质量分数的计算的几种题型
二
有关溶质的质量分数的计算的几种题型
题型1、溶质的质量分数的简单计算
题型1、溶质的质量分数的简单计算
例题1、在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150 kg的这种溶液,需要氯化钠和水的质量各是多少?
【解析】

【练习】把12g某固体放入90g水中充分溶解后过滤,滤出该固体2g,则该滤液的溶质质量分数是( )
A.10% B.11.7% C.12% D.13.3%

题型2、溶液稀释和配制问题的计算
题型2、溶液稀释和配制问题的计算
(1)加水稀释
公式:m1ω1=m2ω2
例题2、把50g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液,需要多少克水?
【解析】
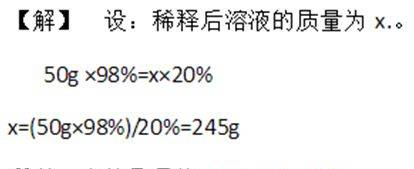
【练习】
1、把100毫升98%的浓硫酸(密度为1.84克/毫升)稀释成10%的稀硫酸(密度为1.07克/毫升),需要加水多少毫升?

2、配制1000mL溶质的质量分数为10%的稀硫酸,需要溶质的质量分数为98%的浓硫酸多少mL?(浓硫酸密度为1.84g/cm3,稀硫酸密度为1.07g/cm3)

(2)浓溶液和稀溶液混合
关键:浓溶液中的溶质+稀溶液中的溶质=混合后溶液中的溶质
例题3、50g20%的食盐水和多少克溶质质量分数为10%食盐水混合可制得15%的食盐水?
【解析】50g×20%+x×10%=(50g+x)15%
x=25g
【练习】
1、多少克溶质质量分数为20%的食盐水和多少克溶质质量分数为10%食盐水混合可制得100g15%的食盐水?
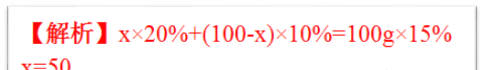
(3)溶液增浓的计算
例题4、有40g溶质质量分数为5%的氯化钙溶液,若将其溶质质量分数增加到10%,可采用什么法?并计算出具体的数值。
A.把溶剂蒸发掉一半
B.加入40g溶质质量分数为10%的氯化钙溶液
C.把溶剂蒸发掉20g
D.加入3g氯化钙晶体
【解析】
方法一:溶剂量不变,增加溶质
设加入氯化钙的质量是x
40g×5%+x=(40+x) ×10%
x=2.2g
方法二:溶质量不变,蒸发溶剂
设蒸发水的质量是x
40g×5% =(40-x) ×10%
x=20g
方法三:加入更浓的溶液
40g×5%+40g×10%=(40+40) ×10% 错误
如果加入20%的氯化钙溶液,需加多少克?
设加入20%的氯化钙溶液的质量是x
40g×5%+x×20%=(40+x) ×10%
x=20g
题型3、含有结晶水的物质溶于水制得溶液,溶质质量分数的计算
题型3、含有结晶水的物质溶于水制得溶液,溶质质量分数的计算
例题5、将5g胆矾溶于95g水中,求所得溶液的溶质质量分数.

【练习】
1、配制质量分数为4%的硫酸铜溶液5kg,需硫酸铜晶体多少kg。

题型4、某些氧化物与水反应制得溶液,溶质质量分数的计算
题型4、某些氧化物与水反应制得溶液,溶质质量分数的计算
例题6、将8g三氧化硫溶于92g水中,求所生成的溶液中溶质的质量分数。

题型5、溶质的质量分数与化学方程式的计算相结合的计算
题型5、溶质的质量分数与化学方程式的计算相结合的计算
解题步骤:

例题7、100g某稀盐酸溶液与25g碳酸钙完全反应。试计算这种稀盐酸溶液中溶质的质量分数。

【练习】
1.溶液加水稀释时,没有发生变化的是()
A.溶质的质量分数
B.溶质的质量
C.溶剂的质量
D.溶液的质量
【答案】B
2.浓度为10%的氢氧化钠溶液20g,若将其浓度增大一倍,应采取的方法是()
A.加20g氢氧化钠
B.蒸去水10g
C.加入20g10%的氢氧化钠溶液
D.将溶液中的水蒸发一半

3.若将12g含有少量铜屑(不与盐酸反应)的铁粉样品放到盛有100g盐酸的烧杯中,恰好完全反应后,烧杯中物质的总质量为111.6g。
试求(1)铁粉样品中铁的质量分数。
(2)反应后所得溶液中溶质的质量分数.


1.《初中化学丨溶液中溶质的质量分数计算总结!》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《初中化学丨溶液中溶质的质量分数计算总结!》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/tiyu/155.html