最近,由辉瑞、阿斯利康(AstraZeneca)和拜耳(Bayer)等17家单位组成的研究小组发布了《注射剂可见异物分类方法标准化白皮书》(一种全行业的生物制药颗粒分类标准化方法和风险分类工具)临床母公司产品),白皮书称,虽然许多制药公司对颗粒异物进行分类,但很少基于科学或风险。白皮书提供了一种标准化的方法,帮助制药公司根据风险客观合理地对颗粒异物进行分类。
解释如下:

摘录如下:
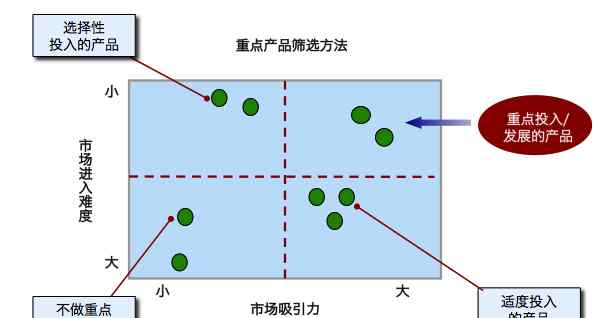
粒子分类
等级
严重缺陷,可能导致缺乏密封性,影响容器完整性或对患者造成伤害9。关键感染(对患者构成最大风险的感染)应分配给AQL,其值较低。通常,关键缺陷的接受数(样品中允许的缺陷单位数)为零。
关键缺陷:可能导致无菌性差,影响容器的完整性或对患者造成伤害。关键缺陷应分配到较低的AQL。一般来说,可接受的关键缺陷数(样本中允许的缺陷单元数)为0。
对患者风险较小的主要和次要缺陷将具有越来越大(不太严格)的AQL值,并接受大于零11的数字。主要缺陷被描述为可能改变产品内容或功能的缺陷12。最小值或缺陷不会影响患者健康或产品功能13。预计颗粒物质将被归类为至少一个主要缺陷。
主要和次要缺陷:对患者的风险较小,可以指定较大(不太严格)的AQL值,允许值大于0。主要缺陷被描述为可能改变产品内容或功能的缺陷。小缺陷是那些不影响患者健康或产品功能的缺陷。颗粒物的分类要求至少是主要缺陷。
粒子知识
粒子知识
产品相关颗粒–产品内颗粒的产生(通常被描述为固有的),包括聚集体或沉淀物,应在产品开发过程中进行评估。必须评估可见产品相关元素的存在,如活性成分或赋形剂(天然的或降解的)的沉淀,以评估对产品稳定性、有效性和安全性的潜在影响。该评估应确定可见产品元素是否被视为缺陷,或用于通知潜在的下游调查。
产品相关颗粒——在产品开发过程中,要对产品中颗粒(通常称为固有颗粒)的形成进行评估,包括聚集或沉淀。有必要评估是否存在可见的产品相关元素,如活性成分或辅料的沉淀(自身或降解),以确定对产品稳定性、有效性和安全性的潜在影响。该评估应确定可见产品元素是否被视为缺陷或用于为潜在的下游调查提供信息。
在整个过程中绘制所有的接触材料图——为了帮助对颗粒进行分类,例如作为(制造过程中)固有的,整个制造过程和接触材料可以被绘制和列出。这有助于解决偏差或调查。
找到过程中所有的接触材料——帮助颗粒分类,比如内部(生产过程),整理列出整个生产过程和接触材料。这有助于解决偏差问题或调查。
微粒的来源——微粒可能与产品或工艺有关(通常分别描述为固有的或固有的),这些微粒可能合理地被发现,因为工艺或接触材料部件,如玻璃、不锈钢、橡胶塞和与管道或工艺相关的fbers。也可能会发现与产品或过程无关的颗粒(通常称为挤压)。这些包括毛发、与加工无关的纤维、昆虫部分和无机/有机材料。这些颗粒可能会增加微生物可提取污染物的风险,因为在进入产品容器之前,对它们的来源或路径知之甚少。
颗粒物的来源——颗粒可能与产品或工艺有关(通常分别描述为固有的或内部的),这些颗粒由于工艺或接触材料部件(如玻璃、不锈钢、橡胶塞和管道或与工艺相关的纤维)而出现是合理的。此外,可能会发现与产品或工艺无关的颗粒(通常称为外来颗粒),包括头发、与工艺无关的纤维、昆虫部分和无机/有机材料。这些颗粒可能会增加微生物或可提取污染物的风险,因为在进入产品容器之前,它们的来源或途径尚不清楚。
地点相关–应包含在检测试剂盒中的颗粒类型取决于地点,因为每个地点都是一个独特的环境,例如,特定材料的独特制造过程将产生该地点的特定颗粒组合
工厂-测试样品中要包含的颗粒类型取决于工厂,因为每个工厂都是一个独特的环境,例如,一个特殊的生产过程和特殊的材料,这将导致工厂的特殊颗粒组合。
测试套件-出于培训目的,需要使用不同的测试套件进行资格鉴定和自动化虚拟仪器设置。测试套件中使用的缺陷可以从工艺废品的典型颗粒中收集,也可以人工制备(如果它们的外观和行为与工艺废品相似)。这些材料或生产缺陷更适合于检验员培训和资格鉴定以及机器验证,因为它们更好地代表了实际的检验性能。球形标准颗粒可用作天然颗粒的替代品;然而,这些最好用于常规的机器校准,而不是验证或检验员资格鉴定,因为它们不会移动或看起来像实际的生产缺陷
测试样本-出于培训目的,需要使用不同的测试样本进行确认和自动光线检查设置。试样中使用的缺陷可以从过程不合格品的典型颗粒中收集,也可以人工制备(如果其外观和行为与过程不合格品相似)。这些材料或生产缺陷是光检人员培训确认和设备验证的首选,因为它们更能代表实际的检验性能。球形标准粒子可以作为天然粒子的替代品;然而,这些最好用于设备的日常校准,而不是由光检查人员进行验证或确认,因为它们不会移动或看起来像实际的生产缺陷。
粒子源
粒子源
外来粒子
外来粒子
与制造过程无关的颗粒被认为是外源性的或“外源性”的;这些包括头发、与加工无关的纤维、淀粉、矿物质、昆虫部分以及类似的有机物质。根据其来源,一些fbers也可能包含在on their定义中。这些颗粒可能会增加微生物或可提取污染物的风险。外部产品可能有产品兼容性问题或GMP问题。
与制造工艺无关的颗粒被认为是外源性的或“外来的”;这包括头发、非加工相关纤维、淀粉、矿物质、昆虫和类似的无机和有机材料。有些纤维也可能是固有缺陷,这取决于它们的来源。这些颗粒可能会增加微生物或可提取污染物的风险。外来颗粒可能存在产品兼容性问题或GMP问题。
这一类所有定义的共同点是,粒子的来源是正常产品接触材料的外侧。外源性颗粒被认为对无菌保证有更大的风险,因为它们的生物负荷未知且不受控制。
这一类别中所有缺陷的共同点是颗粒不是来源于正常的产品接触材料。众所周知,外来颗粒对无菌保证构成更大的风险,因为它们的生物负荷是未知和不受控制的。
固有粒子
内部粒子
其他粒子被认为是“内在的”或来自内部。这些可能来自加工设备或在加工过程中添加或在容器制备过程中未移除的主要包装材料。这些初级产品接触材料可能包括不锈钢、密封件、垫圈、包装玻璃和橡胶、管材和硅酮润滑剂。一些fber也可能包含在固有定义中,这取决于它们的来源。这种颗粒仍然有异物的危险,但通常来自无菌或消毒过的材料,与产品接触时它们的相互作用更为人所知。这些与过程相关的固有粒子应建立控制。
有些粒子被认为是“内部的”或内生的。这可能来自加工设备或内包装材料,它们要么在加工过程中被引入,要么在容器准备过程中未能被移除。这些主要产品的接触材料可能包括不锈钢、密封件、垫圈、包装玻璃和橡胶、管道和硅酮润滑剂。有些纤维也可能是固有缺陷,这取决于它们的来源。这些颗粒仍然存在异物的风险,但它们通常来自无菌或灭菌材料,它们与产品的相互作用更为人所知。这些与工艺相关的固有颗粒是要控制的。
固有粒子
固有粒子
第三类粒子是“固有”粒子,已知或打算与特定产品配方相关联。每一个装有粒子的容器,不管是不是外来的,都应该被拒绝。固有颗粒的物理形式或性质因产品而异,包括溶液、悬浮液、乳液和其他设计为颗粒集合体(附聚物、聚集体等)的药物输送系统。).对于其中聚集体可能形成长链或蛋白质链的基于蛋白质的产品,在产品的货架期变化期间,蛋白质种类可能变成可见的可检测的单个颗粒。与产品配方相关的悬浮液或颗粒形成物应在开发阶段和稳定性样品中进行研究,以确定正常特性和可能发生的基于时间的变化。固有颗粒应在产品的保质期内有规定的允许长度。在适用的情况下,固有的颗粒形状可能包含在产品提交文件或产品专用专论中。
第三类粒子是“固有”粒子,与具体的产品配方有关。固有颗粒的物理形式或性质因产品而异。对于以蛋白质为基础的产品,在这些产品中,聚集体可能会形成较长的链或蛋白质链,在产品有效期内蛋白质发生变化时,可能会明显检测到絮状物或颗粒。应在开发阶段和样品中研究与产品配方相关的悬浮液或颗粒形成,以确定正常特性和可能的时间变化。在产品的保质期内,固有颗粒应有一个允许的概述。在适当的情况下,内在颗粒可能需要包含在产品提交文件或产品标准专论中。
项目团队成员包括:艾伯特维尔、雅力士制药、阿斯利康、拜耳、博健、百时美施贵宝、康德、礼来、葛兰素史克、益普生、杨森、默克、辉瑞、再生器、罗氏、查尔斯、生物制药
微信官方账号
1.《可见异物 注射剂可见异物分类方法标准化》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《可见异物 注射剂可见异物分类方法标准化》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/yule/1219387.html