今天中学化学园整理了初中简单化学碳和二氧化碳的制备相关内容,希望对大家有所帮助。
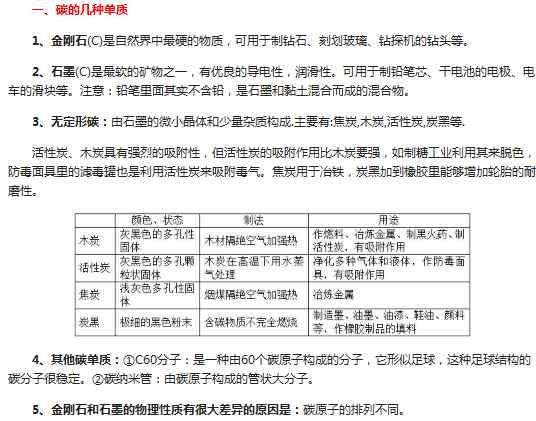
首先,碳的几种简单物质
单质碳的物理性质不同,但各种单质碳的化学性质完全一样!
1.常温下化学性质稳定
(为什么碳在室温下化学性质稳定?碳原子最外层有四个电子,既不容易得到电子,也不容易失去电子,所以碳的化学性质在室温下相对稳定。档案资料一般用碳墨书写,古代书画百年后安然无恙,木质电线杆的埋件用火焚烧以防腐蚀。)
2.碳与氧的反应-易燃性:
(1)在氧气充足的情况下,碳在氧气中充分燃烧生成二氧化碳并释放热量;
(2)氧气不足的情况下,碳燃烧不充分,产生一氧化碳,释放热量。
完全燃烧(充足的氧气)产生CO2:碳+O2点燃CO2
不完全燃烧(氧气不足)产生二氧化碳+氧气来点燃二氧化碳
3.碳与某些氧化物的反应-还原性:
木炭还原氧化铜的实验现象:排出的气体使清澈的石灰水浑浊;黑色粉末中有红色固体。
注意:
(1)碳作为还原剂一般需要大量的热量,这是吸热反应,所以反应条件一般是高温;
(2)操作时注意试管口稍向下;
③配制混合物时,炭粉应略过量,以防止还原的铜被氧气再次氧化。
还原性化学式:C+2CuO高温2Cu+CO2↓(置换反应)
4.应用:冶金工业
1.实验室制气思路:(原理、设备、检验)
(1)发生器:由反应物状态和反应条件决定;
反应物是固体,需要加热。造气时,用高锰酸钾造O2。
反应物为固体和液体或液体和液体,不需要加热。当制造气体时,使用H2发电机。
(2)收集方法:气体的密度和溶解度决定:
水不溶性用引流法收集:CO只能用引流法收集(瓦斯引流空易中毒)
如果密度比为空,则采用向上排放空气法:CO2只能通过向上排放空气法使用(可溶于水,与水反应)
当密度比小于空气体时,采用向下排放空气体的方法
(3)化学实验的注意事项和结论
一、需要研究化学反应原理的实验室制备,是在实验室条件下研究(如室温、加热、添加催化剂等。),有什么药可用,通过什么反应来制造这种气体。
b、需要研究用来制备这种气体的实验设备。实验室制气设备包括发生器和收集器两部分。下面列出了确定气体发生装置和收集装置时应考虑的因素。
(1)气体发生器:
A.反应物的状态:固体与固体反应;固体与液体反应;液体与液体反应。
B.反应条件:常温;加热;添加催化剂等。
②气体收集装置:
A.气体放电空法:密度比为空时,采用向上气体放电空法;下排空气法采用较低密度比空气。
b排水法:不溶于水,不与水反应时,可采用排水法。
1.《碳和二氧化碳反应 初中化学丨碳的单质和二氧化碳的制取!》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《碳和二氧化碳反应 初中化学丨碳的单质和二氧化碳的制取!》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/caijing/1621484.html