中学入学考试
初中化学各单元思维导图,总结初中化学各单元知识点,快速学习。
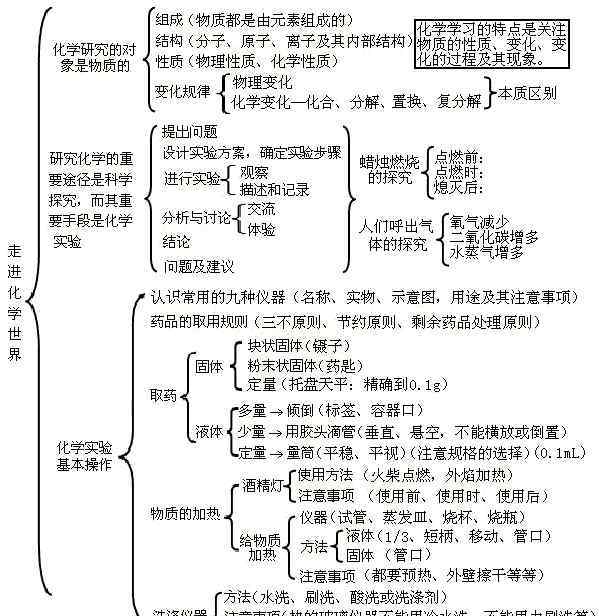
单元1:进入化学世界
我们周围的气体

第三单元:大自然中的水


第四单元:材料构成的奥秘

第五单元:化学方程式

单元6:碳和碳氧化物

单元7:燃料及其利用

单元8:金属和金属材料

第九单元:解决方案

单元10:酸碱盐
一个
化学术语
1.电离方程:
2.物质的常用名称和主要成分:
生石灰CaO;氢氧化钙,熟石灰、熟石灰和石灰水的主要成分;石灰石、大理石CaCO3;盐的主要成分是NaCl纯碱和碳酸钠;烧碱、烧碱、烧碱NaOH;硫酸铜5H2O;用于胆汁明矾和蓝明矾;碳酸钠晶体Na2CO3.10H2O;氨NH3。H2O;;
3.物质的常用名称和主要成分:
生石灰CaO;氢氧化钙,熟石灰、熟石灰和石灰水的主要成分;石灰石、大理石CaCO3;盐的主要成分是NaCl纯碱和碳酸钠;烧碱、烧碱、烧碱NaOH;硫酸铜5H2O;用于胆汁明矾和蓝明矾;碳酸钠晶体Na2CO3.10H2O;氨水NH3.H2O
2
金属迁移率
1.金属活性序列:
K>。Ca>。Na>。Mg>。Al>。Zn & gtFe>。Sn>。铅(氢)铜>铅;Hg >Ag>。Pt>。埃
2.金属活动序列的意义:
按照金属活性的顺序,金属位置越高,在水溶液(酸溶液或盐溶液)中越容易失去电子变成离子,活性越强。
3.金属活性序列的应用:
(1)氢之前的金属可以取代酸中的氢(元素)。
(2)只有前排的金属可以从其盐溶液中替代后排的金属(K、Ca、Na除外)。
三
酸、碱和盐的溶解度
1、食盐和碱的溶解度:
钾(盐)、钠(盐)和铵盐都溶解了,但水影没有硝酸盐。
硫酸盐不溶性硫酸钡,氯化物不溶性氯化银。
碳酸盐只溶解钾(盐)、钠(盐)和铵(盐)。
碱性物质的溶解度:只有钾(氢氧化物)、钠(氢氧化物)、钙(氢氧化物)和钡(氢氧化物)可溶。
2.八种常见沉积物:
氯化银、硫酸钡、碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜和氢氧化铁
3.四种微溶物质:
氢氧化钙(石灰水表示“澄清”的原因),
硫酸钙(实验室二氧化碳生产不使用稀硫酸的原因)
Ag2SO4(鉴别SO42-和Cl-时不使用硝酸银的原因),
碳酸镁(不能用碳酸根离子去除溶液中镁离子的原因)
4.三种不存在的物质:
氢氧化银、碳酸铝和碳酸铁
四
复分解反应的条件反应
有气体、水或沉淀(即有溶液中不存在或水溶液中不易电离的物质)
1.不溶性碱只能与酸性反应;
2.不溶性盐,只有碳酸盐能与酸反应;
3.硝酸钾、亚硝酸钠、硝酸银和硫酸钡在复分解反应中不能作为反应物。
五
溶液的酸碱性及酸碱性的测定
1.酸性溶液时,溶液的指示剂-酸碱紫石蕊试液变红;暴露于碱性溶液时呈蓝色
无色酚酞试验溶液只有遇到碱性溶液才会变红。注:不溶性碱对指示剂无影响;碱性溶液不一定是碱性溶液(特例:碳酸钠水溶液是碱性的)
2.酸碱度-溶液的酸碱度:酸碱度
六
离子检查
Cl-(在溶液中)-向被测溶液中加入硝酸银溶液,如果产生不溶于硝酸的白色沉淀,则原被测溶液中含有氯离子。
SO42-(溶液中)-向待测溶液中加入氯化钡(或硝酸钡,或氢氧化钡)溶液。如果产生不溶于硝酸(或盐酸)的白色沉淀,则待测原始溶液含有硫酸根离子。
CO32-
(1)(固体或溶液)-向被测物质中加入稀酸溶液。如果产生能使澄清石灰水浑浊的气体,原被测物质含有碳酸根离子。
(2)(在溶液中)-向测试溶液中加入氯化钡或硝酸银溶液。如果产生一种可溶于硝酸的白色沉淀,同时产生一种能使澄清的石灰水浑浊的气体,则原来的被测溶液含有碳酸根离子。
[注]
1.鉴别Cl-和SO42-时,用氯化钡溶液代替硝酸银溶液,因为硫酸银是微溶物质,使得鉴别现象不明显;
2.在未知溶液中加入氯化钡溶液时,如果产生不溶于硝酸的白色沉淀,则原测溶液可能含有银离子或硫酸根离子。)
七
物质的颜色
1.固体(大部分是白色)
黑色氧化铜、碳粉、二氧化锰、四氧化三铁、
紫黑色-高锰酸钾
铜和氧化铁的红棕色
蓝色-铜(羟基)2,硫酸铜. 5H2O绿色-铜(羟基)2CO3
2.溶液(大多无色)
淡绿色溶液-(亚铁盐溶液)氯化铁溶液,硫酸亚铁;;
黄色溶液-(铁盐溶液)三氯化铁溶液、Fe2(SO4)3溶液和Fe3(NO3)3溶液;
蓝色溶液-(铜盐溶液)氯化铜溶液、硫酸铜溶液和铜(NO3)2;
蓝绿色溶液-氯化铜溶液(强)。
八
酸、碱和盐的特性
1.浓盐酸易挥发,有刺激性,在空气体中可形成酸雾。
2、浓硝酸-易挥发,气味刺鼻,在空气体中形成酸雾,强氧化。
3.浓硫酸没有挥发性。一种粘稠的油性液体。它有很强的吸水性和脱水性,在溶水时能释放出大量的热量。具有强氧化性。
4.氢氧化钙-白色粉末,微溶于水。
5、氢氧化钠——白色固体,易潮解,溶于水时放大量热量。可与空气体中的二氧化碳发生反应而变质。
6、硫酸铜-白色粉末,溶于水得到蓝色溶液(从该溶液中沉淀出的蓝色晶体为五水硫酸铜. 5H2O)。
7.碳酸钠为白色粉末,水溶液为碱性溶液(溶液中析出的白色晶体为碳酸钠晶体Na2CO3.10H2O)。
8、氨(NH3。H2O)——属于碱性溶液。
九
酸和碱的一般性质以及盐的性质
1、酸的一般性
(1)酸性溶液能使紫色石蕊试液变红,但不能使无色酚酞试液变色;
(2)酸能与活性金属反应生成盐和氢;
(3)酸能与碱性氧化物反应生成盐和水;
(4)酸能与碱反应生成盐和水;
(5)酸可以与一些盐反应生成新的盐和新的酸。
2.碱的一般性
(1)碱溶液能使紫色石蕊试液变蓝,无色酚酞试液变红;
(2)碱能与酸性氧化物反应生成盐和水;
(3)碱能与酸反应生成盐和水;
(4)一些碱可以与一些盐反应生成新的盐和碱。
3.盐的性质
(1)一些盐能与更活泼的金属反应生成新的盐和金属;
(2)有些盐能与酸反应生成新的盐和新的酸;
(3)一些盐可以与一些碱反应生成新的盐和新的碱。
【如果根据网络数据涉及版权,请及时联系我们删除内容!]

1.《酸碱盐思维导图 初中化学各单元知识思维导图,超实用,学霸都在学》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《酸碱盐思维导图 初中化学各单元知识思维导图,超实用,学霸都在学》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/fangchan/1577260.html