pC(g)+qD(g),分析如下:反应mA(g)+nB(g)pC(g)+qD(g)分析如下:
2HI(g),压强的改变对平衡无影响。但增大(或减小)压强会使各物质的浓度增大(或减小),混合气体的颜色变深(或浅)。(3)对于反应前后气体体积没有变化的反应,如H2(g)+I2(g)2HI(g),压力的变化对平衡没有影响。然而,增加(或降低)压力会增加(或降低)每种物质的浓度,并使混合气体的颜色变暗(或变亮)。
(4)在恒定体积下,将反应混合物中每种物质的浓度改变到相同程度应被视为压力的影响,增加(降低)浓度相当于增加(降低)压力。(5)在定容容器中,当改变其中一种气态物质的浓度时,压力必然会发生变化。在判断平衡运动方向和物质转化率、体积分数的变化时,要灵活分析浓度和压力对化学平衡的影响。如果用α表示物质的转化率,用φ表示气体的体积分数,那么:
①对于A(g)+B(g)C(g)类反应,达到平衡后,保持温度、容积不变,加入一定量的A,则平衡向正反应方向移动,α(B)增大而α(A)减小,φ(B)减小而φ(A)增大。(1)对于A(g)+B(g)C(g)反应,达到平衡后,保持温度和体积不变,加入一定量的A,平衡向正反应方向移动,α(B)增大,而α(A)减小,φ(B)减小,φ(A)增大。
②对于aA(g)bB(g)或aA(g)bB(g)+cC(g)类反应,达到平衡后,保持温度、容积不变,加入一定量的A,平衡移动的方向、A的转化率变化,可分以下三种情况进行分析:②对于aA(g)bB(g)+cC(g)反应,达到平衡后,保持温度和体积不变,加入一定量的a来平衡移动方向和a转化率的变化,可以分析为以下三种情况:
cC(g) ΔH=Q kJ·mol−1可逆反应aa (g)+bb (g) cc (g) δ h = q kj mol 1
(1)内容-时间-温度(或压力)图:(当曲线a中使用催化剂而曲线b中未使用催化剂或化学计量数a+b = c时,曲线a的压力大于曲线b的压力)
2NH3(g) ΔH<0。以合成氨反应为例:N2 (g)+3H2 (g) 2nh3 (g) δ h
2.化学平衡图像求解原理
(1)解决问题的思路
cC(g)为例:以可逆反应aa (g)+bb (g) cc (g)为例:
(1)“一议二议”原则在化学平衡图像中,有三个量用纵坐标、横坐标和曲线表示。确定横坐标代表的量后,讨论纵坐标与曲线的关系或确定纵坐标代表的量,讨论横坐标与曲线的关系。如图:
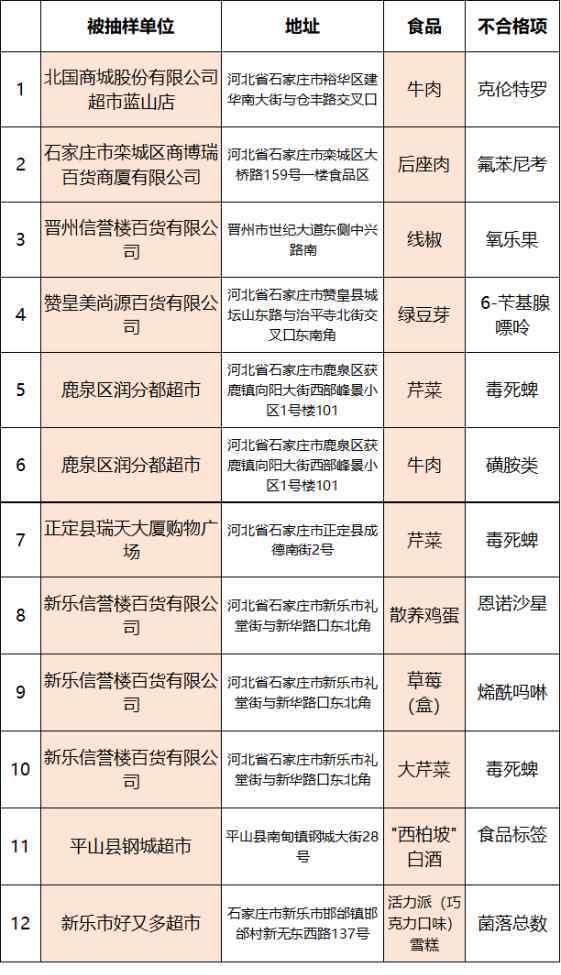
2SO3(g)等温等压、等温等容下建立平衡如下图:(1)对于反应前后气体物质数量变化的反应,如2SO2(g)+O2(g)2SO3(g),在等温等压和等温等容条件下建立平衡,如下图所示:
2HI(g)等温等压、等温等容下建立平衡如下图:(2)对于气体物质的量在反应前后不变的反应,如H2(g)+I2(g)2HI(g),在等温等压和等温等容条件下建立平衡,如下图所示:
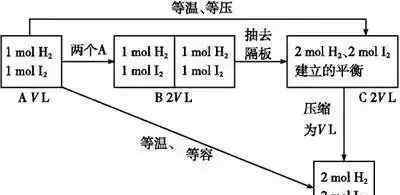
很容易得出a相当于C,a相当于D,因为C→D平衡不动。反应前后用恒定的气体体积给反应加压,平衡不动。
结论:对于反应前后气态物质量恒定的反应,无论是恒温恒压还是恒温定容,只要将加入的物质按化学计量数换算到方程式的一边,就可以用相同的比例建立活性平衡。
5.解决化学平衡运动问题的思维模式

6.构建“虚拟第三平衡”方法解决平衡关系
在解决问题时,如果条件改变后新老天平之间的关系难以比较,可以考虑构造一个与旧天平等效的“虚拟第三天平”,然后通过体积压缩或膨胀的方式与新天平进行沟通,从而形成一个有利于解决问题的新模型,促进条件转化为结论,例如:
(1)构建等温等容平衡思维模式:新的平衡态可以认为是两个原平衡态的简单叠加压缩,相当于增压。
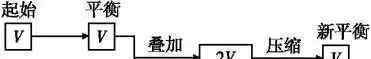
(2)构建等温等压平衡思维模式(以气态物质量增加的反应为例(见图):新的平衡态可以看作是两个原平衡态的简单叠加,压力不变,平衡不动。
1.《化学反应平衡 高中化学:“平衡移动”重难点都在这里了,一定要看!》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《化学反应平衡 高中化学:“平衡移动”重难点都在这里了,一定要看!》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/fangchan/749290.html