5月11日,墨西哥外长埃布拉德宣布,中国公司研发的mRNA新冠疫苗ARCoV将于本月30日起在墨西哥开始III期试验,预计有6000名志愿者参加。
埃布拉德在推特发文称:“中国方面已经正式通知我们,他们将在墨西哥开始,目前正等待墨西哥药品监管机构的批准。”
ARCoV疫苗由云南沃森生物技术公司、苏州艾博生物,以及军事科学院军事医学研究院共同研制,5月起开展海外III期临床试验。路透社称,这是中国首个进入III期临床试验的mRNA疫苗。
为抗击疫情,墨西哥政府正推进疫苗接种计划,已与中国科兴、国药和康希诺公司签署疫苗购买协议。

推文截图
香港《南华早报》12日援引在线数据库ClinicalTrials.gov的数据显示,在III期临床试验中,沃森生物计划在全球招募约2.8万名18岁以上的志愿者,其中至少有25%的志愿者年龄在60岁以上。
这些志愿者将被随机分配到研究组和对照组,分别接受两剂实验疫苗或安慰剂,间隔28天。志愿者的健康状况将被监测12个月。
报道称,此次临床试验的初步研究预计将于10月底完成。
据公开资料显示,沃森生物于2020年研发出ARCoV疫苗,并于当年6月获得国家药品监督管理局的药物临床试验批件,随即进入二期临床试验阶段。据悉,前两期临床数据较理想。
ARCoV疫苗拥有自主知识产权,其核心原料和关键设备已实现国产化。2020年12月,沃森建设中国首个mRNA新冠疫苗生产车间,ARCoV疫苗预计8个月内建成投产,一期产能为1.2亿剂/年。
今年3月,沃森生物联合创始人黄镇曾表示,该公司已经联系墨西哥、哥伦比亚、印度尼西亚、巴基斯坦和土耳其,可能会在今年下半年开始试验。他还表示,试验的中期分析数据将在今年年底获得。
今年4月,艾博生物创始人英博博士接受央广网专访时也透露,该疫苗最快在5月份正式开启海外多中心临床试验,首选地或在南美洲,“会考虑当地疫情的情况,缺乏研发能力和疫苗供给的国家优先考量,这样能有效帮助当地控制疫情”。
mRNA,即Messenger RNA,是把遗传信息从DNA传递到蛋白质的信使,为人体细胞提供指令,产生靶标蛋白,从而激活人体免疫反应,抵抗相应的病毒。和其他类别的疫苗相比,mRNA疫苗最大的优势在于生产环节及研发周期短,工艺相对简单,可以快速推进生产。
截至目前全球共有两款mRNA疫苗获批,分别为德国BioNTech公司与辉瑞合作研发的BNT162b2与美国Moderna公司研发的mRNA-1273。但两者储运温度条件相对苛刻,分别需要摄氏零下-70度和-20度。
预期对比前两款疫苗,ARCoV疫苗的差异在于可在2-8摄氏度环境下保存。在医学期刊《Cell》上公布的动物试验中,为了评估ARCoV的热稳定性,军事医学科学院秦成峰教授团队将疫苗最长在常温中储存7天,然后将它注射到小鼠体内仍然有效。这使得ARCoV可以大大降低冷链运输的挑战。
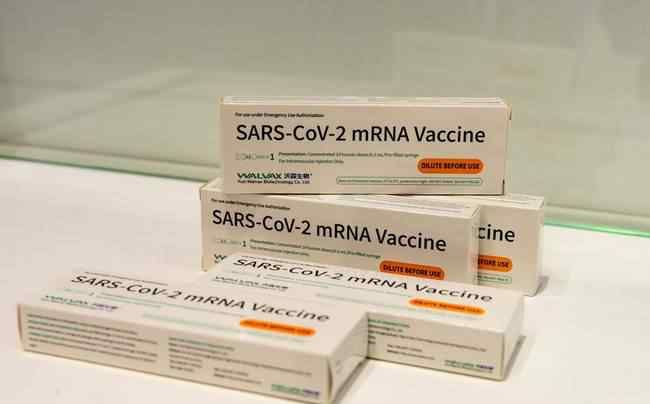
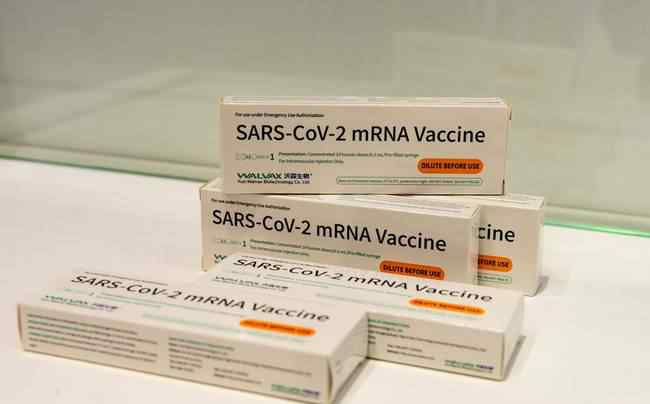
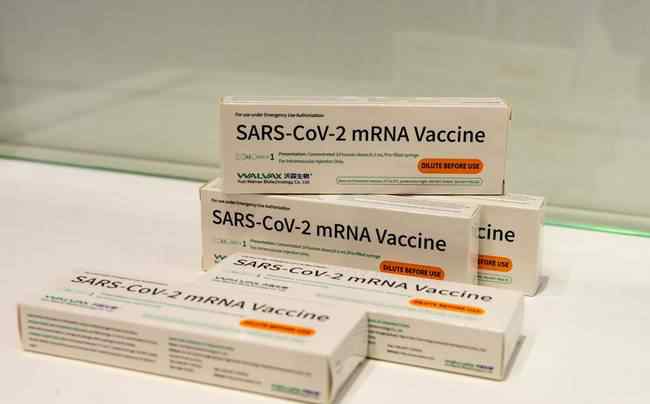
沃森生物mRNA疫苗
截至目前,我国已有5个生产企业的新冠病毒疫苗批准附条件上市或紧急使用。其中,附条件批准上市的有3个灭活疫苗和1个腺病毒载体疫苗;此外,还有1个重组新冠病毒疫苗,即智克威得疫苗获批紧急使用。
“大家要关注mRNA疫苗,它给人类提供了无限的思考。”4月10日,中国疾病预防控制中心主任高福在2021全国疫苗与健康大会上呼吁,mRNA技术对传染病、艾滋病、遗传病、罕见病、肿瘤将提供各种机会,希望在研发经典传统疫苗的时候,考虑到mRNA疫苗可能给人类带来的收益。
高福在报告中表示,一定要关注mRNA疫苗,不能因为我国现在已经有了几种新冠病毒疫苗,而忽略了mRNA疫苗。需要创新思维,创造性地做出mRNA疫苗。
除ARCoV疫苗外,中国复星mRNA新冠疫苗的研发进程也在顺利进行。
2020年3月13日,复星医药产业与拜恩泰科签订《许可协议》,获得授权在中国大陆及港澳台地区内临床试验、上市申请和商业化基于其专有的mRNA技术平台研发的、针对新冠病毒的疫苗产品。
5月10日,复星公司在上交所发布公告称,控股子公司复星医药产业拟与德国拜恩泰科投资设立合资公司,以实现mRNA新冠疫苗产品的本地化生产及商业化。
5月11日,墨西哥外长埃布拉德宣布,中国公司研发的mRNA新冠疫苗ARCoV将于本月30日起在墨西哥开始III期试验,预计有6000名志愿者参加。
埃布拉德在推特发文称:“中国方面已经正式通知我们,他们将在墨西哥开始,目前正等待墨西哥药品监管机构的批准。”
ARCoV疫苗由云南沃森生物技术公司、苏州艾博生物,以及军事科学院军事医学研究院共同研制,5月起开展海外III期临床试验。路透社称,这是中国首个进入III期临床试验的mRNA疫苗。
为抗击疫情,墨西哥政府正推进疫苗接种计划,已与中国科兴、国药和康希诺公司签署疫苗购买协议。

推文截图
香港《南华早报》12日援引在线数据库ClinicalTrials.gov的数据显示,在III期临床试验中,沃森生物计划在全球招募约2.8万名18岁以上的志愿者,其中至少有25%的志愿者年龄在60岁以上。
这些志愿者将被随机分配到研究组和对照组,分别接受两剂实验疫苗或安慰剂,间隔28天。志愿者的健康状况将被监测12个月。
报道称,此次临床试验的初步研究预计将于10月底完成。
据公开资料显示,沃森生物于2020年研发出ARCoV疫苗,并于当年6月获得国家药品监督管理局的药物临床试验批件,随即进入二期临床试验阶段。据悉,前两期临床数据较理想。
ARCoV疫苗拥有自主知识产权,其核心原料和关键设备已实现国产化。2020年12月,沃森建设中国首个mRNA新冠疫苗生产车间,ARCoV疫苗预计8个月内建成投产,一期产能为1.2亿剂/年。
今年3月,沃森生物联合创始人黄镇曾表示,该公司已经联系墨西哥、哥伦比亚、印度尼西亚、巴基斯坦和土耳其,可能会在今年下半年开始试验。他还表示,试验的中期分析数据将在今年年底获得。
今年4月,艾博生物创始人英博博士接受央广网专访时也透露,该疫苗最快在5月份正式开启海外多中心临床试验,首选地或在南美洲,“会考虑当地疫情的情况,缺乏研发能力和疫苗供给的国家优先考量,这样能有效帮助当地控制疫情”。
mRNA,即Messenger RNA,是把遗传信息从DNA传递到蛋白质的信使,为人体细胞提供指令,产生靶标蛋白,从而激活人体免疫反应,抵抗相应的病毒。和其他类别的疫苗相比,mRNA疫苗最大的优势在于生产环节及研发周期短,工艺相对简单,可以快速推进生产。
截至目前全球共有两款mRNA疫苗获批,分别为德国BioNTech公司与辉瑞合作研发的BNT162b2与美国Moderna公司研发的mRNA-1273。但两者储运温度条件相对苛刻,分别需要摄氏零下-70度和-20度。
预期对比前两款疫苗,ARCoV疫苗的差异在于可在2-8摄氏度环境下保存。在医学期刊《Cell》上公布的动物试验中,为了评估ARCoV的热稳定性,军事医学科学院秦成峰教授团队将疫苗最长在常温中储存7天,然后将它注射到小鼠体内仍然有效。这使得ARCoV可以大大降低冷链运输的挑战。

沃森生物mRNA疫苗
截至目前,我国已有5个生产企业的新冠病毒疫苗批准附条件上市或紧急使用。其中,附条件批准上市的有3个灭活疫苗和1个腺病毒载体疫苗;此外,还有1个重组新冠病毒疫苗,即智克威得疫苗获批紧急使用。
“大家要关注mRNA疫苗,它给人类提供了无限的思考。”4月10日,中国疾病预防控制中心主任高福在2021全国疫苗与健康大会上呼吁,mRNA技术对传染病、艾滋病、遗传病、罕见病、肿瘤将提供各种机会,希望在研发经典传统疫苗的时候,考虑到mRNA疫苗可能给人类带来的收益。
高福在报告中表示,一定要关注mRNA疫苗,不能因为我国现在已经有了几种新冠病毒疫苗,而忽略了mRNA疫苗。需要创新思维,创造性地做出mRNA疫苗。
除ARCoV疫苗外,中国复星mRNA新冠疫苗的研发进程也在顺利进行。
2020年3月13日,复星医药产业与拜恩泰科签订《许可协议》,获得授权在中国大陆及港澳台地区内临床试验、上市申请和商业化基于其专有的mRNA技术平台研发的、针对新冠病毒的疫苗产品。
5月10日,复星公司在上交所发布公告称,控股子公司复星医药产业拟与德国拜恩泰科投资设立合资公司,以实现mRNA新冠疫苗产品的本地化生产及商业化。
1.《疫苗三期试验 事件详情始末介绍!》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《疫苗三期试验 事件详情始末介绍!》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/junshi/1657783.html