自媒体文章《江湖就是人情世故》11月12日中午出炉后,在资本市场和医药界已引起了较大的反响,有媒体质疑其是为了阻断君实生物参与国家药品价格判断,有人说,君实生物是被用来描述人际关系的“媒介”。
我们无意参与自媒体文章引发的争论,但担忧不专业的表述可能会造成公众对我国创新药的推进和药品审批、管理体制产生误解。
艾迪药业ACC007片的审批可能更快
11月12日,《时报新药观察》发表的文章《人民金融·创新药指数涨1.6% | 9个创新药临近上市,贝达药业重磅新药就要批了》中,提到了一个新药的审批速度。
艾迪药业的抗艾滋病1类新药ACC007片,从7月23日上市申请获受理,到国家药监局完成现场核查仅仅用了4个月。2015年1月21日,君实生物PD-1单抗临床试验申请获得受理,2016年1月14日获得批准,用时一年;2018年3月20日,君实生物PD-1单抗上市申请获受理,2018年12月21日获批,用时9个月。从当前进展看,如无意外,ACC007片上市审批的时间大概率会比君实生物的PD-1单抗少。
2018年4月28日,国家药监局从收到默沙东提交9价宫颈癌疫苗上市申请到批准,用时只有8天。
新药审批效率的提高,得益于2015年起的药品审批制度持续改革。这轮药品审批制度改革,推出了临床试验默许、国际多中心、优先审评等制度,加快了填补临床空白、国内临床急需的抗癌药、突破性疗法、孤儿药、儿童用药等的审批速度,引用了FDA抗癌药关键临床二期数据申报上市的做法,使得新药审评审批的时间从过去的6年左右降至3年左右,甚至缩短到一年左右。
制度变革后,新药审评、审批过程中还有没有人为因素我们不清楚,但看到的不当竞争案例不少,从申请优先审评到审批,到进入医保等各个环节中都有恶意举报等行为存在,信达生物PD-1单抗申请上市过程中也曾因某种原因先撤回再重新申报。当然,不能就此妄断《江湖就是人情世故》有恶意。
安全性是新药审批的第一原则
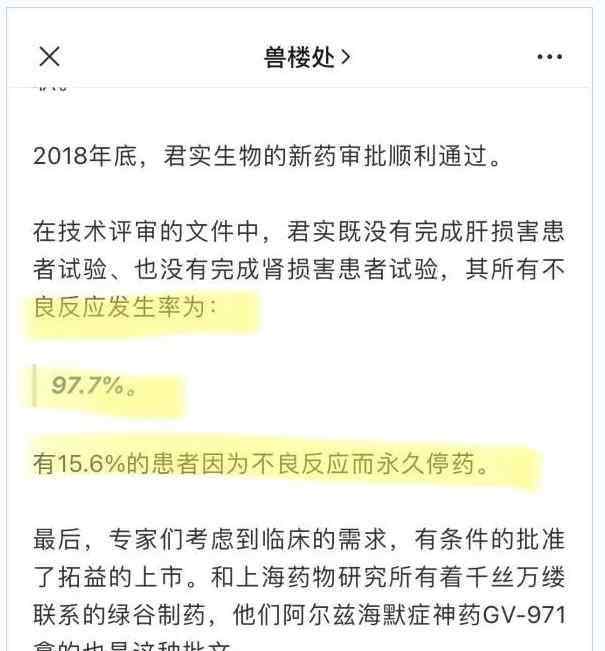
《江湖就是人情世故》提到君实生物的PD-1单抗所有不良反应率97.7%,但未说明所有不良反应率与严重不良反应率的区别,让受众误以为君实生物的PD-1单抗是“毒药”,进一步对药监部门职业操守产生怀疑。
对此,君实生物和一些医药专业人士都做了解释,以说明严重不良反应率在可承受范围内。君实生物在回应中特别强调了其PD-1单抗也获得了美国食品药品监督管理局的认可,言下之意,安全性是没问题的。
目前新冠疫苗的关注度可说是最高的,辉瑞等新冠疫苗曾因安全性问题暂停临床试验,我国新冠疫苗临床数据发布时,先说安全性,再说中和抗体等药效数据。新药研发或审批原则中,安全性是第一位,其次才是有效性。理论上说,谁也不敢让一个毒药上市销售。
我国药品审批历史上曾出现过滥批新药的情况,近年推出了严厉的责任追究机制。这个制度已形成了“双刃剑”,新药审评、审批员们不仅不敢胡乱审评了,甚至有了“多一事不如少一事”的心态,审评审批中是严谨再严谨。
总的来说,新药审评、审批由技术审评和行政审批两部分组成,技术审评环节最为关键。国家药监局药品审评中心负责对新药进行技术审评,在认为符合上市标准,并拿到中国食品药品检定院新药样品检验合格报告、中国食品药品审核查验中心现场检查合格报告后,提交国家药监局药品注册司审批。药审中心新药审评中还引入了外部专家参与的专家审评会制度,一个新药在药品审评中心初审完成后,通过专家审评会的审议才能进入下一步程序。
国家药监局药品注册司行政审批中,要召开答辩会,让药审中心审评员和外部专家陈述同意注册的理由,过了注册司这一关,还需分管局长签字同意才能正式发出批文。如此长的审评、审批链条,如果是个“毒药”,谁也不敢让其上市销售。
《江湖就是人情世故》还提到了绿谷制药阿尔兹海默症药GV-971拿的也是君实生物PD-1一样的有条件上市批文。对于这个药,业界是有争议,但临床效果也很明显。不知文章是顺便提一下,还是另有意思。
新冠药品研发国际竞争中需要国际合作
《江湖就是人情世故》称君实生物新冠病毒抗体药品美国上市之路已经大概率胎死腹中了。重要的论据是,合作者礼来在美国停止了JS016的临床研究。
10月7日,君实生物公告:礼来制药已在美国健康受试者中成功完成了JS016(LY-CoV016)的I期临床研究(NCT04441931),以评估其安全性、耐受性、药代动力学特征及免疫原性。截至目前,JS016(LY-CoV016)的耐受性良好,且概无观察到与药物有关的严重不良事件。
11月7日,君实生物官微发表文章《君实生物合作伙伴礼来携手产学研共话全球抗疫》,文章称:礼来正全速推进在海外的临床试验——BLAZE-1是一项随机、双盲、安慰剂对照的临床研究,6月17日已进入II期临床试验阶段,这项研究旨在评估LY-CoV555和LY-CoV016在门诊治疗有感染症状的COVID-19患者的有效性和安全性。
从公告和官微文章来看,礼来并未在美国停止JS016的临床研究,作者显然是未正确引用材料。
找到疫苗和新药才是遏制新冠疫情的有效措施,新冠疫苗和药品的研发既有国际竞争,也需要国际合作。由于我国只有零星病例,新冠疫苗三期临床试验和新药临床试验需要在新冠高发地区进行,君实生物研发JS016过程中需要与礼来制药紧密合作。
这方面我国有过经验教训。我国曾研发过非典疫苗和中东呼吸综合征疫苗,都因为疫情结束、病例减少,最后无疾而终。
11月12日,为推动中国与世界抗疫合作,加强科技交流,外交部礼宾司组织26国驻华大使和高级外交官访问国药集团中国生物北京生物制品研究所,深入了解国药集团中国生物新冠疫苗科技研发、临床试验和生产情况,并与企业负责人、科研人员对话交流。
客观地说,《江湖就是人情世故》写得不够扎实,但闹出的动静已不小。如果文章能够推动我国药品管理制度继续前行、激励我国企业更加注重创新药的研发,即是幸事。
1.《毒药 君实生物只是自媒体说人的“媒介”?用意不好揣测,表述粗糙可确认》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《毒药 君实生物只是自媒体说人的“媒介”?用意不好揣测,表述粗糙可确认》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/caijing/567371.html