这里《化学妹妹》为大家整理初中化学知识点总结,帮助大家提前预习!(立即点击标题下的蓝色单词“初中化学”,获取更多学习方法和干货!)
1 .物质的学名、通用名和化学式

(1)金刚石和石墨:c
⑵汞和汞:汞
(3)生石灰和氧化钙:氧化钙
(4)干冰(固体二氧化碳):CO2
(5)盐酸和盐酸:盐酸
(6)硫酸:H2SO3
(7) H2SO4: H2S
(8)熟石灰和熟石灰:氢氧化钙
(9)烧碱、烧碱和烧碱:氢氧化钠
(10)纯碱:Na2CO3
碳酸钠晶体和纯碱晶体:Na2CO3 10H2O
(11)碳酸氢钠和酸性碳酸钠:碳酸氢钠(也叫小苏打)
(12)胆矾、蓝矾和硫酸铜晶体:硫酸铜5H2O
(13)绿脓杆菌和孔雀石:Cu2(OH)2CO3(分解成三种氧化物的物质)
(14)甲醇:CH3OH有毒,盲目,死亡
(15)酒精和乙醇:C2H5OH
(16)乙酸、乙酸(16.6℃冰乙酸)、CH3COOO(CH3COO-乙酸根离子)具有酸的共性
(17)氨气:NH3(碱性气体)
(18)氨水和一水氨水:NH3 H2O(是一种常见的碱,具有碱的共性,是一种不含金属离子的碱)
(19)亚硝酸钠:亚硝酸钠(工业盐,有毒)
常见物质的颜色状态

1.白色固体:氧化镁、五氧化二磷、氧化钙、氢氧化钠、氢氧化钙、氯化钾、KCl、碳酸钠、氯化钠和无水硫酸铜;;铁和镁是银白色的(水银是银白色的液体)
2.黑色固体:石墨、碳粉、铁粉、氧化铜、二氧化锰和四氧化三铁
▲KMnO4为紫黑色
3.红色固体:铜、氧化铁、氧化汞和红磷
▲硫:浅黄色
▲ Cu2(OH)2CO3为绿色
4.溶液的颜色:
含Cu2+的溶液为蓝色。
含Fe2+的溶液为淡绿色。
所有含Fe3+的溶液都是棕黄色,其余溶液一般不是无色的。
5、沉淀(即不溶性盐和碱):
①盐:白色↓: CaCO3、BaCO3(溶于酸)、AgCl、BaSO4(也不溶于稀硝酸)等
②碱:蓝色↓: Cu (OH) 2红棕色↓: Fe (OH) 3白色↓:其他碱。
6、
▲注:有刺激性气味的液体:盐酸、硝酸、醋酸。酒精是一种带有特殊气体的液体。
7.有毒,
气体:一氧化碳
液体:CH3OH
固体:亚硝酸钠硫酸铜(可用作杀菌剂,与熟石灰混合制成蓝色粘稠物质——波尔多液)
3物质的溶解度

1.盐的溶解度
含钾、钠、硝酸盐和铵的物质都溶于水
只有氯化银不溶于水,其他的溶于水。
只有硫酸钡不溶于水,其他都溶于水。
只有K2CO3、Na2CO3和(NH4)2CO3溶于水,其他不溶于水
2.碱的溶解度
易溶于水的碱包括氢氧化钡、氢氧化钾、氢氧化钙、氢氧化钠和氨水,其他碱不溶于水。
Fe(OH)3为红棕色沉淀,Cu(OH)2为蓝色沉淀,其他不溶性碱为白色。
化学是最好的
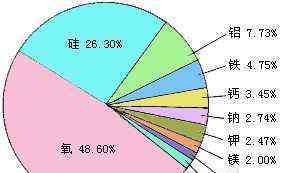
1.地壳中最丰富的金属元素是铝。
2.氧是地壳中最非金属的元素。
3.空气体中含量最多的物质是氮气。
4.最坚硬的天然物质是钻石。
5.最简单的有机物是甲烷。
6.金属活性序列表中活性最高的金属是钾。
7.相对分子质量最小的氧化物是水。最简单的有机化合物CH4
8.相同条件下密度最低的气体是氢气。
9.最导电的金属是银。
10.相对原子质量最小的原子是氢。
11.熔点最低的金属是汞。
12.人体中最丰富的元素是氧气。
13.化合物种类最多的元素是碳。
14.日常生活中使用最广泛的金属是铁。
15.中国最早使用天然气;中国最大的煤炭基地是:山西省;湿法炼铜最早使用是在中国(西汉时发现[刘安《淮南万壁书》“曾庆铁化铜”],宋代应用);最早发现电子的是英国的汤姆逊;空气体由N2和O2组成的最早结论是法国拉瓦锡。
5初中化学中的“三”
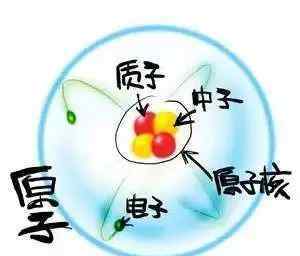
1.构成物质的三种粒子是分子、原子和离子。
2.氢气、一氧化碳和碳是常用于还原氧化铜的三种还原剂。
3.氢作为燃料有三个优点:资源丰富,热值高,燃烧的产物是水,不污染环境。
4.原子一般由三种粒子组成:质子、中子和电子。
5.黑色金属只有三种:铁、锰和铬。
6.构成物质的元素可以分为三类,即
(1)金属元素,(2)非金属元素和(3)稀有气体元素。
7.氧化铁有三种,化学式为(1)FeO,(2)Fe2O3,(3) Fe3O4。
8.该解决方案有三个特点
(1)一致性;(2)稳定性;(3)混合物。
9.化学方程式有三层含义:
①表示什么物质参与了反应,结果生成了什么物质;
(2)反应物和产物之间分子或原子的粒子数比;
(3)表示反应物和产物之间的质量比。
化学方程式有两个原则:基于客观事实;遵循质量守恒定律。
10.生铁一般分为三种:白口铁、灰口铁和球墨铸铁。
11.碳钢可以分为三种:高碳钢、中碳钢和低碳钢。
12、炼铁常用的铁矿石有三种:
(1)赤铁矿(主要为fe2o 3);
(2)磁铁矿(fe3o 4);
(3)菱铁矿(FeCO3)。
13.炼钢的主要设备有三种:转炉、电炉和平炉。
14.通常与温度有关的三个反应条件是点火、加热和高温。
15.将饱和溶液变为不饱和溶液有两种方法:
35.质量守恒解释的原子不变:类型不变,数量不增不减,质量不变
36.与空气体混合,点燃三种可能爆炸的气体:H2、一氧化碳和甲烷(实际上是任何可燃气体和灰尘)。
37.煤碳化(化学变化)的三种产物:焦炭、煤焦油和焦炉煤气
38.浓硫酸的三大特性:吸水、脱水、强氧化
39.使用酒精灯的三大禁令:在燃着的灯里加入酒精,把嘴吹出来
40.溶液制备的三个步骤:计算、称重和溶解
41.生物细胞中含量最多的前三种元素:O、C、h。
42.原子中的三个方程:核荷数=质子数=核外电子数=原子数
43.构成物质的三种粒子:分子、原子和离子
6化学实验反应

1.基本反应类型:
化学化合反应:多变的反应
分解反应:越来越多
置换反应:一单换一单
复分解反应:交换离子
2.常见元素的价(正价格):
一价元素如钠、钾、银氯化氢、
氧、钙、锌、钡和镁的二价元素,
三价金属元素铝和铁;
可变化合价并不难,
两到四个碳硅,
三五氮磷,
二、四、六硫都有。
3.实验室制氧步骤:
"茶(止)、庄(装)、集、令、收、利(离)、息(灭)"
“检查”装置的气密性“包装”药物并连接好装置
“固定”试管固定在铁架的“点”上,点燃酒精灯加热
收集的气体通过导管离开水面
“熄灭”酒精灯,停止加热。
4.一氧化碳还原氧化铜的实验步骤:
一次通过,两点,三次熄灭,四次停止和五次处理
“一通”先通氢气,“两点”后点燃酒精灯加热;
“三次熄灭”实验结束后,先熄灭酒精灯,待室温“四停”后,停止通氢;“五个处理”处理尾气,防止一氧化碳污染环境。
5.水电解的实验现象;
“正氧负氢,正一负二”:阳极放出氧气,阴极放出氢气;氧气和氢气的体积比为1: 2。
6.构成地壳的元素:养育女儿(氧、硅、铝)
7.原子最外层与离子和化合价形成之间的关系:
“失去正阳,则得负阴,但数值不变”:阳离子是原子最外层失去电子后形成的,元素的化合价为正;原子最外层得到电子形成阴离子,元素化合价为负;电子的得失=电荷=价。
8、化学实验的基本操作公式:
实心需要勺或纸槽,一送,两竖三弹;
木块固定比镊子好,一横,二横,三慢竖
液体要装在小瓶里,用手贴上标签,然后倾倒;
读数应与切面平齐,底部低,顶部高
在滴管上加一个捏头,垂直悬挂空无污染;
不要放错地方,打扫完别忘了。
托盘平衡要平,游动螺丝要对准中心;
把东西放在左边,放在右边。镊子有大有小
先把试纸切下来,玻璃棒蘸液体测最好;
先将测试纸弄湿进行气体测量,然后粘在杆上向气体倾斜
加热酒灯的外焰,三分之二为上限;
硫酸在水中搅拌并缓慢注入,以防止沸腾和飞溅
先检查气密性,隔网加热杯瓶;
排水和气体收集后,首先抽出导管,然后移动灯
9、金属活动顺序:
金属活性的顺序是从强到弱:
钾钙钠镁铝锌铁锡铅(氢)铜汞银铂金
10、"交叉法"写公式公式:
“正价左负价右,十字减号,右是非”
11、过滤操作公式:
桶架烧杯玻璃棒,滤纸漏斗角度相同;
过滤前让它静止,别忘了。
12、实验中的规律:
(1)固体加热产生的气体全部采用高锰酸钾O2装置(固体加热型);
当固体和液体不加热反应产生气体时,选择用过氧化氢产生O2的装置(固液不加热型)。
(2)任何加热试管内固体的人都要先预热,试管口要稍微向下倾斜。
(3)所有产生的不溶于水(不与水反应)的气体都可以通过排水的方法收集。
所有产生的密度高于空气体的气体均可采用向上排放空气体的方法收集。
所有密度小于空气体的生成气体均可采用向下排放空气体的方法收集。
(4)进行气体实验时,首先检查装置的气密性。导管应显示1-2毫升橡胶塞,铁夹应夹在离喷嘴1/3处。
⑤用长颈漏斗做气体实验时,长颈漏斗的末端喷嘴应插在液面以下。
⑥点燃可燃气体时,首先要检查其纯度。
⑦用有毒气体做实验时,尾气必须最后处理。
⑧用还原性气体还原金属氧化物时,必须是“一遍、两点、三次熄灭、四次停止”
13、反应定律:
位移反应:
②等质量的不同酸与足量的金属反应,酸的相对分子质量越小,释放的氢越多。
(3)相同质量的酸与足够多的不同金属反应,释放出同样多的氢。
(4)金属+酸→盐+H2↓反应后,溶液变重,金属变轻。
金属+盐溶液→新金属+新盐:
(1)当金属的相对原子质量大于新金属的相对原子质量时,反应后溶液的质量变重,金属变轻。
②当金属的相对原子质量小于新金属时,反应后溶液质量变轻,金属变重。
15、催化剂:
一变二不变(改变一种物质的反应速率,化学性质和质量不变的物质就是催化剂)
氧化剂和还原剂:
获得氧氧化还原还原剂的还原性,获得失氧氧化还原氧化剂的氧化性(带走氧元素的物质为还原剂,失去氧元素的物质为氧化剂)
16.气体清洗瓶除杂连接:长入短出
洗气瓶排水集气连接:短入口长出口
用洗气瓶排放空气体收集气体连接:密度小,短时增长,密度大,短时增长。
17.实验除杂原理:先去除其他物质,再去除水蒸气
实验检验原则:先水后物
18.氢气还原氧化铜
先通入氢气,然后点灯,当材料变红时,将灯取下;冷却至室温,停止氢气
酒精灯“来晚走早”,氢气“来早走晚”
包公静静地坐在水晶房间里,微风习习。突然,大火从地面开始燃烧,包公变成了关云长。云长令火退,只留清风吹温室。”
提示:
1.《氧化剂和还原剂口诀 知识储备 | 化学基础知识总结和常用口诀,又全又好记!》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《氧化剂和还原剂口诀 知识储备 | 化学基础知识总结和常用口诀,又全又好记!》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/fangchan/614903.html