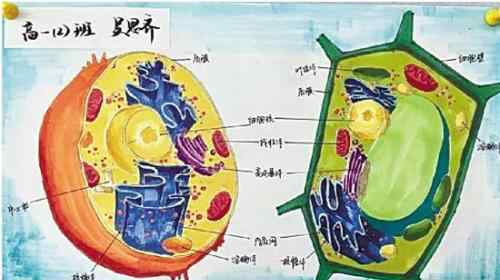
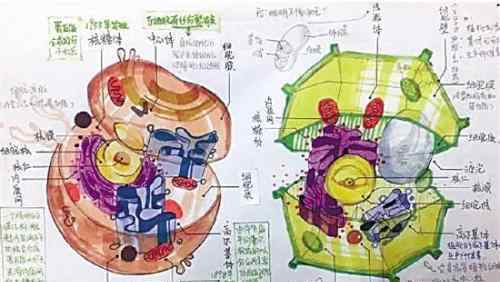
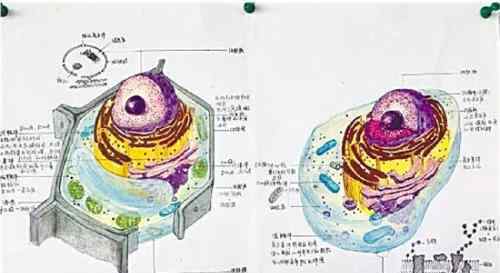
在自然界中,大多数高等动物新生命的开始来自父亲精子和母亲卵子的结合。精卵结合形成受精卵,新生命诞生。在生殖过程中,单倍体生殖细胞(精子和卵细胞)负责将父母的遗传信息传递给后代。
精子和卵子的原始细胞是生殖干细胞。生殖干细胞作为成体干细胞的一种,具有自我更新和分化为生殖细胞的能力。在维持数量的同时,不断产生分化的生殖细胞,通过减数分裂形成配子。
研究表明,哺乳动物雄性生殖干细胞只占生殖细胞总数的0.02-0.03%,但这大约一万个细胞肩负着重要的任务,一生需要产生数千个精子[1]。正常男性一生可以产生超过9520亿个成熟精子。
在雌性哺乳动物中,正常雌性动物一生中只能产生相对较少的成熟卵子。比如一个正常的女人一生只能产300-500个成熟的卵子。这是否意味着女性卵巢中没有生殖干细胞,或者生殖干细胞的数量极其稀少?
1.生殖干细胞的起源
为了充分理解“生殖干细胞”,让我们抛开关于女性生殖干细胞的世纪争论。我们来看看。男女生殖细胞的原始来源在哪里?
生殖干细胞,你是哪里人?
我们先从小鼠胚胎发育开始,再引入人类胚胎发育来看生殖细胞的起源。
1)胚胎期的生殖细胞
在小鼠胚胎发育过程中,生殖细胞的祖细胞PGC(原始生殖细胞)在第7天原肠胚阶段开始出现。
E7天是什么意思?指胚胎发育的第七天,从受精卵形成开始。众所周知,胚胎干细胞是多能性的,可以分化成各种类型的细胞。这个大哥存在于E3.5天胚泡期内细胞团的ICM中。
PGC通过细胞迁移和长途跋涉到达了胚胎的生殖嵴。在此过程中,PGC数逐渐增加,在生殖嵴中定居,然后分化为生殖细胞:雄性胚胎中的精原细胞和雌性胚胎中的卵原细胞。
经过分化发育,生殖嵴最终形成男性性腺睾丸和女性性腺卵巢,而PGC最终成为性腺中的生殖细胞。
总之,包括生殖干细胞在内的所有生殖细胞都来源于胚胎期的原始生殖细胞PGC。
图1:小鼠原始生殖细胞PGC(棕色细胞)在胚胎中的分布变化
在胚胎发育过程中,原始生殖细胞从最初的外胚层穿过背侧中胚层,最终到达生殖细胞层,引自载永汉:……鸟类的基因组编辑。"
2)出生后的生殖细胞
那么,在出生前夕,精原细胞和卵原细胞会安静地呆在自己的地方大睡一觉吗?
卵母细胞不是,她很勤奋。雌性小鼠出生前夕(E20),卵原细胞大量增殖,进行减数分裂,形成初级卵母细胞。老鼠在出生前形成数千个初级卵母细胞,而雌性则达到数百万个数量级。这些卵母细胞只停留在第一次减数分裂的双线期,出生后大多会程序化死亡。
出生后,睾丸和卵巢会继续发育。
精原细胞在睾丸中逐渐分化。精子发生始于性成熟。通过减数分裂和有序分化,依次形成初级精母细胞、次级精母细胞和圆形精子。最后,圆形精子形成蝌蚪形成熟精子,形成生殖能力。
卵巢性成熟时,卵母细胞已进入第二次减数分裂,形成次级卵母细胞,最后排卵,进入输卵管,形成生殖能力。
类似于雌性小鼠的卵巢发育过程,人类雌性小鼠出生时卵巢内约有200万个卵泡(一个卵母细胞+N个颗粒细胞形成一个卵泡),青春期时只剩下约30万个卵泡。数量看似庞大,但正常女性一生大约有300-500个卵泡可以成熟排卵。
图2。哺乳动物卵巢结构示意图
卵巢中的卵细胞和颗粒细胞形成卵泡结构。在排卵周期中,原始卵泡发育成初级卵泡和次级卵泡。卵细胞形成囊泡小球后,脱离卵泡结构,从卵巢排出。剩余的卵泡结构逐渐缩小形成黄体(引自kevincoward:哺乳动物生殖生理学)
2.找到你心脏里的生殖干细胞
哺乳动物的生殖器官中充满了各种类似的细胞,那么如何从细胞的浩瀚海洋中知道哪些细胞是生殖干细胞,哪些细胞不是呢?
开始寻找生殖干细胞的旅程
1)男性生殖干细胞的发现
按照传统观念,出生时精原细胞的数量是一定的。如果没有生殖干细胞提供精原细胞,导致精原细胞耗竭,男性产生精子的能力就会迅速消失。
但事实并非如此。如前所述,男性一生可以产生超过5250亿个成熟精子,并具有持续产生精子的能力。那么睾丸中一定有这样一种细胞,不断补充精子产生所损失的精原细胞。这种细胞符合干细胞的标准,即必须有男性生殖干细胞。一方面不断分化补充精原细胞进行精子发生,另一方面不断更新自身,维持数量,避免干细胞资源枯竭。
我们知道,哺乳动物的睾丸内有大量的曲细精管,一个成年人所有曲细精管的总长度可达260米。这些生精小管负责精子的产生,成熟的精子可以通过输精管排出体外。
那么位于生精小管的干细胞在哪里呢?
小鼠性成熟时,睾丸的生精小管呈“中空”结构,内含各分化阶段的生殖细胞,如生殖干细胞、精母细胞等。,大量成熟精子聚集在管中心附近,而男性生殖干细胞位于管壁附近(图2和图3)。
图3。哺乳动物睾丸、生精小管结构和精子形成过程示意图
睾丸内有大量的生精小管,支持细胞、生殖细胞或精子细胞、初级精母细胞、次级精母细胞、圆形精子和成熟精子从管外到管中心分布在弯曲的精巢壁上。
那么男性生殖干细胞是如何被发现的呢?
1994年,美国人Brinster RL教授首次将小鼠精原细胞(包括生殖干细胞)注射入无生精能力小鼠的生精小管,恢复了小鼠的生殖能力,并通过实验首次证明了小鼠体内存在雄性生殖干细胞。经过大量的研究工作,体外分离培养了雄性生殖干细胞,并发现了一些标记物如PLZF等用于体内鉴定雄性生殖干细胞。如下图所示,小鼠雄性生殖干细胞用Stell4蛋白标记(图3,绿色细胞为生殖干细胞)。
图4。雄性生殖干细胞在新生小鼠体内的定位:绿色细胞为Sall4+雄性生殖干细胞
蓝色为细胞核,红色为支持细胞,说明男性生殖干细胞位于支持细胞所在的生精小管外壁附近
人睾丸的生精小管结构和干细胞定位模式与小鼠相似。然而,直到2009年,人类男性生殖干细胞才被长期分离和体外培养。
所以我们可以看到,在成年男性睾丸中,生殖干细胞位于曲细精管外壁附近,数量很少,但功能极其强大:比如男性生殖干细胞需要承担产生5250多亿个成熟精子的任务。
2)女性生殖干细胞的发现
传统观念仍然认为雌性哺乳动物卵细胞的数量在出生时就已经确定,不会更新增加,而是在性成熟后随着排卵而减少。比如一个正常的雌性一生只能产300-500个成熟卵。
这是否意味着哺乳动物出生后卵巢内没有生殖干细胞,导致卵子枯竭,将女性的生殖年龄限制在16-50岁?
图:卵细胞形成过程
然而,最近的研究结果挑战了这一传统观点,证明出生后卵巢中仍有支持卵细胞更新的女性生殖干细胞。
乔纳森·蒂莉和吴季教授首先发起了这项挑战。
2004年,乔纳森·蒂利教授在哈佛医学院工作时,发现成年小鼠卵巢内有旺盛的分裂生殖细胞,通过计数卵泡数量的变化,证明卵细胞更新在成年期仍然存在[5]。这是科学界首次提出哺乳动物卵巢生殖干细胞存在的证据。
2009年,《自然细胞生物学》发表了上海交通大学吴季教授的研究成果。利用磁珠分选技术从小鼠卵巢中成功分离出雌性生殖干细胞,可在体外稳定培养和传代。将干细胞移植到无卵泡生成能力的小鼠卵巢后,受体小鼠的生育能力恢复,证明细胞具有分化为卵细胞的能力[6]。
乔纳森·蒂利(Jonathan Tilly)和吴吉教授首次定位了小鼠卵巢生殖干细胞:卵巢皮质表面(图5)。
图5。女性生殖干细胞的定位
用免疫组织化学(MVH信号)和免疫荧光(MVH绿色信号、BrdU红色信号)对小鼠卵巢雌性生殖干细胞进行定位,表明它们存在于皮层
2012年,乔纳森·蒂利(Jonathan Tilly)教授使用类似的流式分选技术,从人类卵巢中分离出生殖干细胞,该干细胞可以进行有丝分裂,并具有卵子分化的能力。
此后,越来越多的研究者从大鼠、猪等哺乳动物中分离出女性生殖干细胞,越来越多的证据支持哺乳动物中存在女性生殖干细胞。
3.生殖干细胞有望在未来出现
目前,中国人口协会《中国不孕不育状况12年调查报告》保守估计,中国不孕不育人数已达4000万,占育龄人口的12.5%,即每8对夫妇中就有1对有不孕不育问题,在北上广等一线城市甚至超过15%。
图6。不孕症的年龄和性别比例统计(引自《中国不孕症现状调查报告》)
所以,很多人都在怀疑,男性生殖干细胞的研究能否解决男性不育的问题。还是可以通过对女性生殖干细胞的研究,找到延长女性生殖时间,延缓女性卵巢衰老的好方法?还是想办法解决女性不孕的问题?
我只能说未来是有希望的:生殖干细胞的研究可能是解决这些问题的关键之一。
1)产前筛查
如果利用生殖干细胞鉴定与不孕不育相关的基因突变,将为产前筛查提供参考。现有资料显示,男性不育中,遗传因素导致的不育占4%。单基因/多基因突变或染色体畸变影响精原干细胞的功能或微环境的改变,最终导致干细胞丢失或精子发生受阻[7]。
2)药物开发
例如,利用生殖干细胞研究生殖细胞分化和增殖的关键途径,可以为药物设计提供靶点。使用靶向药物抑制或激活干细胞相关通路,增强人体生精排卵功能,治疗弱精子症和少精子症。
3)细胞储存
或提供生殖干细胞储存服务,为高危放射环境工作人员、化疗放疗患者等提供干细胞提取、扩增和储存方案。来保护他们的生育能力。
总的来说,现实是残酷的,但未来可能是美好的。随着干细胞技术的发展,人们认为生殖干细胞可以更好地造福人类。
希望早日实现从板凳到旁边。
参考文献:
精原干细胞:从规范到临床相关性的更新[J]。人类生殖更新,2019。
[2]韩俊英,朴俊海.鸟类原始生殖细胞介导的转基因及基因组编辑[J].动物科学与生物技术杂志,2018,9(1): 19。
3 NegusN C,Berger P J .哺乳动物生殖生理学[M]//当前哺乳动物学。斯普林格,波士顿,马萨诸塞州,1987: 149-173。
[4]萨德里-阿德卡尼赫,米兹拉克,范达伦,等.人精原细胞的体外增殖[J].中国科学院学报,2002 .Jama,2009,302(19): 2127-2134。
[5]约翰逊,坎宁,卡内科,等.生殖系干细胞与出生后哺乳动物卵巢卵泡更新[J].《自然》,2004,428(6979): 145。
[6]邹k,袁z,杨z,等.从新生卵巢来源的种系干细胞系产生后代[J].自然细胞生物学,2009,11(5): 631。
精原干细胞:从规范到临床相关性的更新[J]。人类生殖更新,2019。
1.《生殖细胞 人类繁衍的秘密:生殖干细胞》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《生殖细胞 人类繁衍的秘密:生殖干细胞》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/keji/1052304.html