2020年前三季度,NMPA批准上市33种新药,包括23种进口药品和10种国产药品。药物种类方面,化学药物17种,生物药物12种,中药3种,疫苗制品1种。
注:一、这里所列的新药主要是指NMPA首次批准在中国上市的药物,包括新分子实体、生物药物、中药和疫苗。其中新的分子实体主要是化学药物注册分类下的1类和5.1类;生物药品主要属于生物制品注册分类下的1类和2类。不包括生物类似物、新适应症和新剂型。旭化成公司的b .萘哌地尔和葛兰素史克的盐酸安非他酮缓释片因仿制药已在国内获批多年,仁福药的注射用瑞舒拉姆苯磺酸盐和恒瑞的注射用瑞舒拉姆甲苯磺酸盐已在国内率先获批,故未列入本表。
在2020年前三季度获准在中国上市的5.1种新药中,西谷神星拥有阿巴思普注射液的中国权利,北海康成拥有马来酸奈拉替尼片和Edu硫酸酯酶β注射液的中国权利,复星制药拥有马来酸阿瓦替尼片的中国权利。
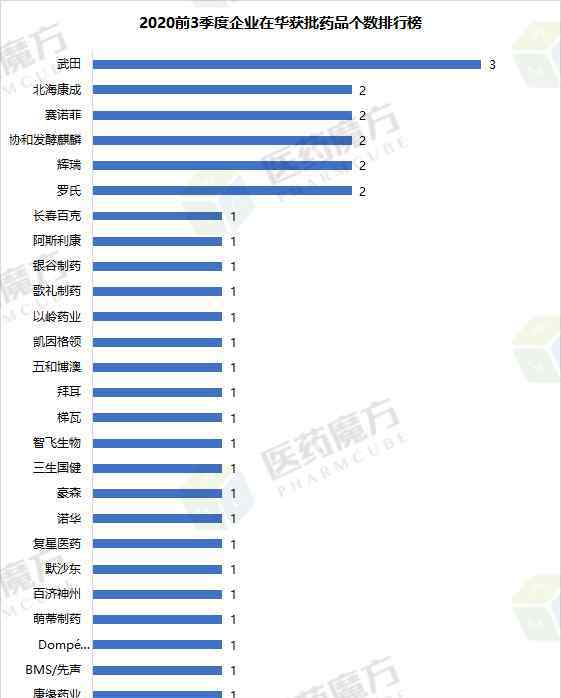
从企业的角度来看,2020年前三季度,武田获得的新药数量是中国最多的,有三个。罗氏、辉瑞、赛诺菲、协和发酵麒麟、北海康成各有两种新药在国内获批。
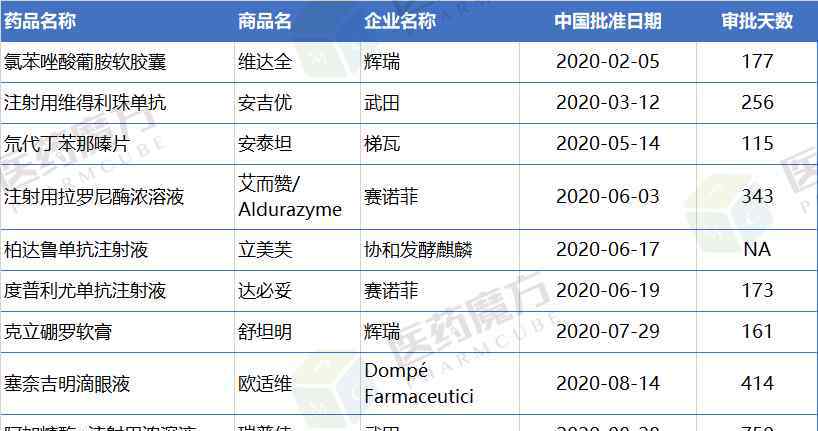
此外,在2020年批准上市的23种进口药物中,有9种急需在海外使用。从批准天数来看,Berdyzumab在提交临床申请后直接被批准上市,而氘代丁嗪片在中国上市仅用了115天,克伦特罗软膏从申报上市到最终批准的时间为161天。
在2020年的前三个季度,迫切需要海外药物
注:不包括新适应症的应用

点亮“看”,配好文章
1.《nmpa 2020前3季度NMPA批准的新药》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《nmpa 2020前3季度NMPA批准的新药》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/junshi/622563.html




