自批量发行制度在我国实施以来,批量发行制度不断完善。近年来,我国批量发行产品的生产已经标准化,质量稳定可控。2016年共发放疫苗3949批,占6.46亿人;4025批血液制品,占5927.8万瓶,836批血液筛查试剂,占8.78亿人。
批量发放用于特定血源筛查的体外诊断试剂
详情如下:
三、血液筛查体外诊断试剂分批发放
(1)2016年血源筛查试剂发放情况概述
根据《药品管理法》和《药品管理法实施条例》,血源筛查体外诊断试剂按生物制品管理,分批发放。每批产品上市前必须经过中国检验研究院的批准。经过生产企业多年的严格监管,近年来生产企业整体稳定,血源筛查用体外诊断试剂质量良好,连续五年批次检验合格率达到100%。2016年,中央检验所共发放836批用于血源筛查的体外诊断试剂,涉及人员约8.78亿人,涉及9个品种,24家生产企业。其中进口产品64批(占下达批次总数的8%),约3000万人(占下达总人数的3.5%),涉及6个品种,5家进口生产企业。具体数据见表8和图12。与2015年相比,这两年不同品种发行的批次差异不大(图13)
表8 .2016年血源筛查体外诊断试剂发放情况
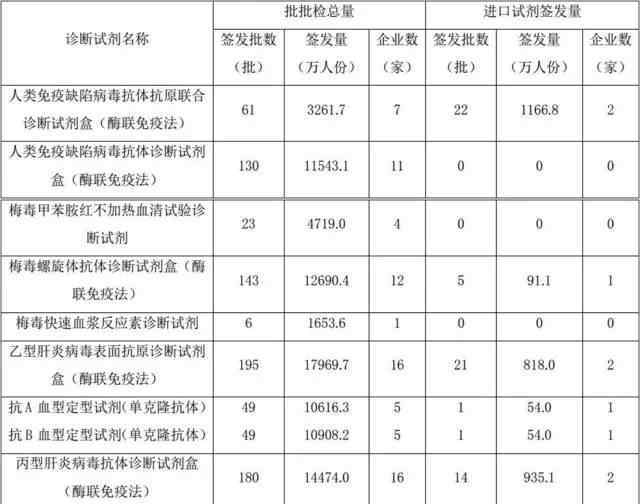
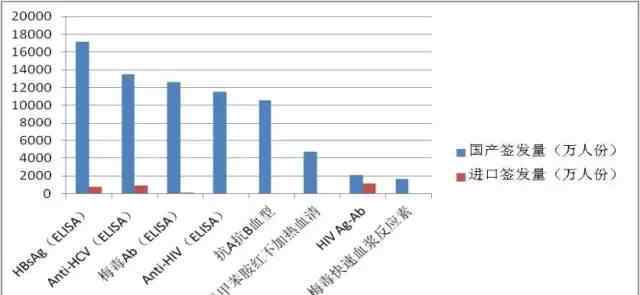
图12。2016年国产和进口血源筛查体外诊断试剂发放量
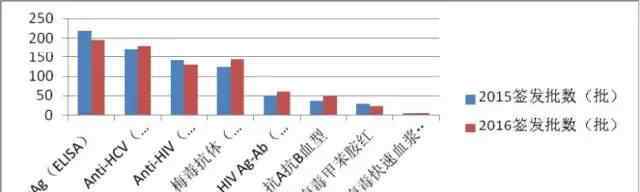
图13。2015年和2016年血源筛查体外诊断试剂批次比较
(二)实施批量发放HBV/丙型肝炎病毒/艾滋病核酸检测血液筛查试剂
2016年2月23日,国家质检总局召开“核酸检测血液筛查试剂批量发放工作会议”,拟实施核酸检测血液筛查试剂批量发放。为了保证这项工作的顺利进行,根据总局会议精神,我院生物制品检定所于2016年3月21日召开了“核酸检测用血液筛查试剂批量发放沟通会”,与核酸检测用血液筛查试剂生产厂家进行沟通,听取他们的意见,为保证核酸检测用血液筛查试剂批量发放的顺利实施奠定了基础。
医疗器械创新网络
微信号:innoMD
分享行业创新信息,提供专业服务
【声明】本文转载,医疗器械创新网对其准确性和意见不负责。如果涉及版权问题,请联系0512-85667873。我们会立即处理,以保护双方的权益。谢谢你。
1.《血源筛查 CFDA:2016年生物制品批签发年报 有血源筛查用体外诊断试剂批签发详情》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《血源筛查 CFDA:2016年生物制品批签发年报 有血源筛查用体外诊断试剂批签发详情》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/junshi/689144.html





