2018年是最值得的国内三期临床试验
根据药智中国临床试验数据库,2018年(截至9月14日)共进行了107项临床试验,其中一些重要的临床试验值得关注,如与癌症药物相关的临床试验36项,与慢性病和常见病相关的临床试验9项,与其他药物相关的临床试验9项。
癌症相关药物的3期临床试验
在2018年进行的癌症相关药物三期临床试验中,20项由国内企业申请,其余由外资企业申请。34个项目正在进行中,1个项目已经完成,1个项目尚未开始。使用最多的实验机构是中国医学科学院肿瘤医院4家,中国人民解放军八一医院3家,上海胸科医院3家,复旦大学附属肿瘤医院3家。具体如下图所示:

01 7百时美施贵宝Opdivo的临床试验
2018年,百时美施贵宝在中国开展了7项与尼沃玛相关的临床试验。商品名为Opdivo的Nivolumab于今年6月在中国上市。Nivolumab是国内首个获准上市的PD-1肿瘤药物,用于治疗非小细胞肺癌。Nivolumab由小野制药(Ono)和bristolmeyersquibb(BMS)联合开发,并于2014年7月4日获得日本医药医疗器械综合署(PMDA)的批准,于2014年12月22日获得美国食品和药物管理局(FDA)的批准,于2015年6月19日获得欧洲药品管理局(EMA)的批准。2018年在中国开展的几项三期临床试验如下图所示,涉及非小细胞肺癌、尿路癌、食管癌或胃食管结合部癌、局限性

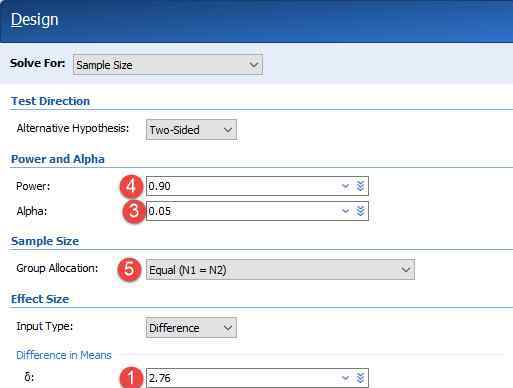
02百济神舟BGB-A317四项临床试验
2018年,百济神舟开展了与BGB-A317相关的三期临床试验,适应症为鳞状非小细胞肺癌、非鳞状非小细胞肺癌、食管鳞状细胞癌和肝细胞癌。BGB-A317是百济神舟正在研究的重要PD-1抗体,备受关注。属于一种叫做“免疫检查点抑制剂”的肿瘤免疫制剂。BGB A317的作用机制是与细胞表面的PD-1受体结合。BGB-A317对PD-1有很高的亲和力和特异性。据百济神州介绍,这种药物与目前批准的PD-1抗体的区别在于通过生物工程技术特异性去除了与Fcgamma受体的结合能力。目前,BGB-A317作为单一药物和组合药物成分,在许多临床试验中也探索了对一系列肿瘤物种的治疗作用。

03恒锐马来酸吡咯烷酯片
2018年7月18日,恒瑞自主研发的创新药物马来酸吡咯烷酮片开始了三种药物术前联合治疗乳腺癌的三期临床试验,以确定其药物的安全性和有效性。然后在8月份,国家药品监督管理局有条件批准上市治疗复发性或转移性乳腺癌的恒锐马来酸吡咯烷酯片,引起了业界的关注。马来酸吡咯烷酯是一种不可逆的酪氨酸激酶抑制剂,具有人表皮生长因子受体2(HER2)和表皮生长因子受体(EGFR)的双重靶标。
04恒瑞甲磺酸阿帕替尼片的新适应症
2018年1月1日,恒瑞推出甲磺酸阿帕替尼联合S-1作为晚期胰腺癌二线治疗的III期干预临床试验。甲磺酸阿帕替尼最早由美国Advenchen Laboratories合成,后由江苏恒瑞制药开发。2014年10月17日获得中国食品药品监督管理局(CFDA)批准,商品名为爱坦,适用于转移性胃癌的治疗。现在恒瑞还在研发这种药物对其他肿瘤的治疗效果。
05二价和四价人乳头瘤病毒疫苗
2018年,9价宫颈癌疫苗将有条件批准在中国上市,让许多有需要的人有新的预防机会。同时,中国也在研究二价和四价疫苗。2018年开展了名为“HPV-058研究中健康中国女性受试者HPV疫苗免疫应答持续性”的二价人乳头瘤病毒吸附疫苗有效性三期临床试验,试验于2月28日开始,6月29日结束,历时4个月。此外,进行了一项名为“一项多中心、随机、双盲、安慰剂对照的三期临床试验,旨在评估四价重组人乳头瘤病毒疫苗(6、11、16、18型)(汉逊酵母)在18-45岁中国女性中的保护性功效、安全性和免疫原性”的三期四价重组人乳头瘤病毒疫苗临床试验。目前正在进行中,预计2023年3月25日结束。
与慢性病和常见病相关的药物
3期临床试验
此外,2018年,开展了多项慢性病和常见病相关药物的三期临床试验,其中4项由国内企业投标,其余由外资企业投标。有4个糖尿病药物试验,4个关节炎药物试验和1个阿尔茨海默病试验。


罗氏AD药物克伦珠单抗注射液
2018年5月,罗氏推出了针对前驱至轻度阿尔茨海默病患者的朱奈珠单抗注射液三期临床试验,旨在评估朱奈珠单抗与安慰剂相比在前驱至轻度阿尔茨海默病(AD)患者中的疗效、安全性和药代动力学。临床试验机构为中国医学科学院北京协和医院。
07甘精胰岛素相关临床试验
在过去的18年里,礼来公司和山东新时代公司分别对甘精胰岛素注射液LY2963016和重组甘精胰岛素注射液进行了3次临床试验。礼来主要是评价LY2963016和乐泰治疗1型糖尿病和2型糖尿病的安全性和有效性。山东的新时代是研究重组甘精胰岛素注射液治疗需要胰岛素治疗的2型糖尿病的安全性和有效性。
甘精胰岛素由赛诺菲开发,于2000年4月20日获得FDA批准,2000年6月9日获得EMA批准,2003年11月7日获得CFDA批准,2008年1月30日获得PMDA批准。甘精胰岛素是一种长效人胰岛素类似物,能刺激骨骼肌和脂肪组织对葡萄糖的摄取,抑制肝脏葡萄糖的产生,从而降低血糖。该药物被批准用于成人和患有1型糖尿病和成人2型糖尿病的儿童的血糖控制。
08傅宏翰林重组人鼠嵌合抗体
CD20单克隆抗体注射液
2018年6月11日,傅宏翰林推出重组人鼠嵌合抗CD20单克隆抗体注射液治疗类风湿性关节炎三期临床试验,旨在研究HLX01联合MTX治疗中重度活动性类风湿关节炎的安全性和有效性。目前国内也有10家企业申请了重组人鼠嵌合抗CD20单克隆抗体注射液的临床应用,全部获得批准。但只有傅宏翰林速度更快,已经进行了三期临床试验。
其他3期临床试验
除上述内容外,还有一些其他药物类型的临床试验值得关注,如Ixekizumab治疗中重度斑块型银屑病的安全性和疗效研究,以及与盐酸右美托咪定注射液、地佐辛注射液、注射用普那布林浓缩液、重组质粒-肝细胞生长因子注射液等药物相关的临床试验。具体如下图所示:


数据来源:药智中国临床试验数据库
1.《神州宏网 2018最值得一看的国内3期临床试验》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《神州宏网 2018最值得一看的国内3期临床试验》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/guoji/807335.html