世界上到处都是花和鸟,五彩缤纷,给人一种美丽的感觉。宏观世界是这样,微观世界也是这样。大部分分子由两个以上的原子组成,不同分子中原子的空排列方式不同,所以分子有各种各样的三维构型,构成了一个五彩缤纷的微观世界。
为了预测分子的三维构型,发展了很多结构理论,一个很简单的理论叫做价层电子对排斥理论。价层电子对排斥理论也叫VSEPR理论。
根据价电子对理论,分子的三维构型是中心原子的价电子对互斥的结果。
中心原子,也就是以原子为中心,一般是一个。
价层电子对是分子或离子中心原子上的电子对,包括σ键电子对和孤电子对。
σ键电子对数是键电子对数,可以由分子式确定。
中心原子上的孤电子对数为未键合电子对数,中心原子上的孤电子对数可由下式计算:
中心原子上孤电子的对数=
a代表中心原子的价电子数。价电子数等于原子的最外层电子数;
x是与中心原子结合的原子数,即中心原子周围的原子数。比如H2O,中心原子为O,H与O结合的原子个数为2,x = 2;
b是原子与中心原子结合所能接受的最大电子数。h为1,其他原子=“该原子的8价电子数”
例如CH4,中心原子为C,中心原子的价电子数为a=4,与中心原子结合的原子数为x=4,中心原子C周围的原子H所能接受的最大电子数为b=1。孤电子对数==1/2=0,价层电子对数为σ键电子对数加孤电子对数=4+0=4。
阴离子中孤电子对的数量=
阴离子中孤对电子数=
NH4+,中心原子为n,a=5,x=4,b=1。孤电子对数==1/2=0,价层电子对数为4。
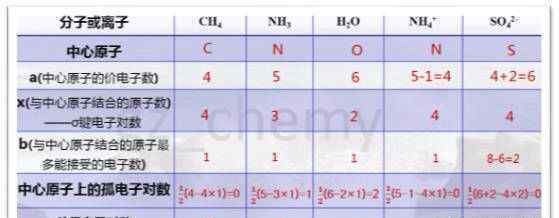
几个分子或离子的中心原子上的孤立电子对数
通过本微课,你会对价层电子的互斥理论有更深入的了解,本微课介绍了孤电子对数和价层电子对数的计算,简单易学!
根据价层电子对排斥理论,当价层电子对为2时,在空之间呈直线排列,键角为180度。当价层电子对数为3时,平面三角形排列在空之间,键角为120度。当价层电子对数为4时,在空之间呈正四面体排列,键角为109° 28’。这是它们的理想构型,其中包含孤电子对,也叫VSEPR模型。
价层电子对数是4个分子或离子的理想构型,即VSEPR模型,都是正四面体。
在这节微课中,我们用三维模型推测了分子的三维构型。
在分子的三维构型中,VSEPR模型中中心原子上的孤电子对应该忽略。
CH4中没有孤电子对,其三维构型为正四面体,键角为109° 28’。
NH3分子中心原子n上的孤电子对的对数为1,省略了VSEPR模型中中心原子上的孤电子对,NH3的三维构型为三角锥。由于孤对的排斥力,键角减小到107°±18°。
H2O分子中心原子o上的孤电子对的对数为2,通过在VSEPR模型中省略中心原子上的孤电子对,得到H2O的立体构型为v形,由于两个孤电子对的排斥作用,键角减小到104°。
NH4+中没有孤电子对,三维构型为正四面体。
SO42-中没有孤电子对,三维构型为正四面体。
结论:当中心原子没有孤对时,VSEPR模型与三维构型一致,但当有孤对时,不一致。
这些都是化合价层电子对数为4的分子或离子的VSEPR模型和三维构型,化合价层电子对数分别为2和3的简单分子或离子的三维构型可以用同样的方法推导出来。你可以试试。
判断简单分子或离子三维构型的方法;
1.确定中心原子的价层电子对数;
2.预测相应的理想几何构型,即VSEPR模型;
3.根据孤对的有无确定三维构型。
更多精彩内容请关注微信微信官方账号:中学化学园
1.《价层电子对互斥理论 10分钟帮你理解选3“价层电子对互斥理论”知识点!》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《价层电子对互斥理论 10分钟帮你理解选3“价层电子对互斥理论”知识点!》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/caijing/1790706.html