这是一种非常有用的氰基取代方法。生成的氰基可以进一步水解得到羧基,羧酸可以不同程度的还原得到醛和醇。反应条件一般为醇类和水作为混合溶剂,反应需要高温,也可以使用DMSO、DMF等非质子极性溶剂。
(2)叠氮化物
利用卤原子和磺酸盐将醇转化为胺,再利用烷基膦进行Staudinger反应,可以将醇转化为氨基,是一种非常有效的间接方法。最常用的方法是PPh3:
其反应机理是:
(3)氧亲核试剂
甲基和苄基底物是这种方法合成的最合适的醚类化合物,其他基团可能导致副反应,如底物的消除。
(4)氮亲核试剂(加百利合成法)
2.芳香族卤化物和磺酸盐
(1)亲核芳香取代反应
这是一种非常有效的方法,氮气反应条件往往苛刻。只有特定的芳环才能发生这样的反应,例如,在芳环的邻位和/或对位有强的吸电基团。
(2)乌尔曼联轴器
乌尔曼反应的经典应用是芳香醚的合成,其中Cu(I)试剂在高温下作为催化剂,ArO-Cu(I)可能是反应的中间体。此外,胺也可以用作反应的组分,然而,这种转化现在通常通过布克沃德-哈特威格反应来实现。例如[1]:
在Buchward-Hartwig反应中,醇、酚等氮亲核试剂可以作为反应的一种组分,另一种组分是芳基卤化物或芳基磺酸盐。反应条件温和有效,需要钯或镍作为催化剂。
一般反应过程如下:
几个例子:
A.芳基-2o烷基偶联[4]
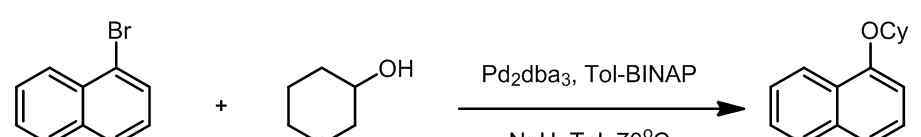
B.杂环芳烃的偶联[5]
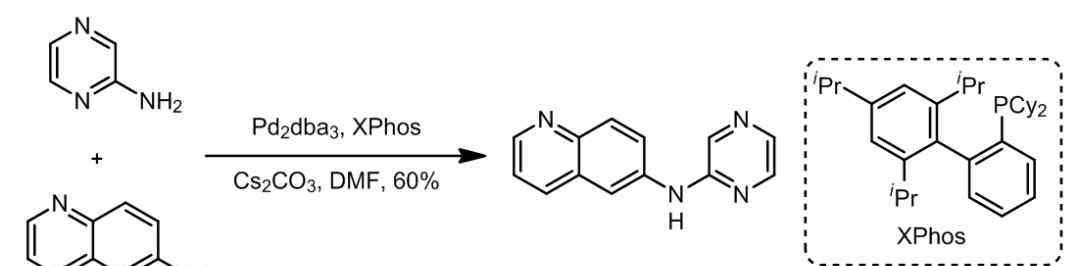
C.杂环芳烃的偶联[5]
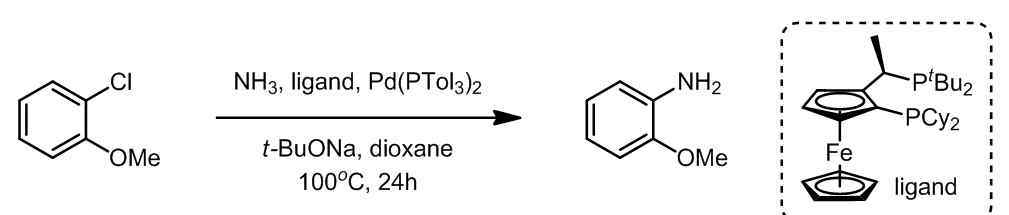
由于氨与金属钯的强相互作用,氨很难直接参与偶联反应,因此反应中需要使用过量的氨。
(3)禅林耦合
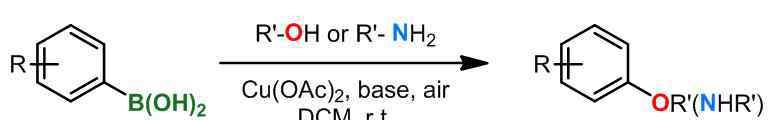
1998年,Chan和Evans报道了芳基、杂环芳香硼酸和芳基在乙酸酮催化下的偶联反应,底物包括苯酚、苯硫酚、芳香胺等。一个例子[6]:
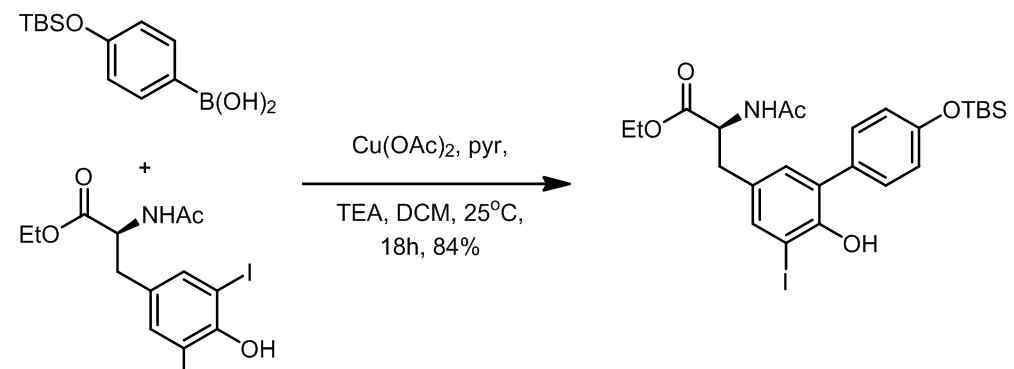
引用
J. Am. Chem. Soc.1997, 119, 43, 10539-10540, doi: 10.1021/ja971901jAngew. Chem. Int. Ed., 1998, 37, 2046, doi:10.1002/(SICI)1521-3773(19980817)37:15<2046::AID-ANIE2046>3.0.CO;2-LAngew. Chem. Int. Ed., 2008, 47, 6338, doi: 10.1002/anie.200800497J. Am. Chem. Soc.1997, 119, 143395-3396, doi: 10.1021/ja9640152Angew. Chem. Int. Ed., 2006, 45, 6523, doi: 10.1002/anie.200601612Tetrahedron , 1998, 39, 2937, doi:10.1016/S0040-4039(98)00502-4版权独家欢迎分享,未经许可拒绝转载
1.《取代反应 【有机反应百科】官能团的转化——卤原子和磺酸酯的反应 第一部分 亲核取代反应》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《取代反应 【有机反应百科】官能团的转化——卤原子和磺酸酯的反应 第一部分 亲核取代反应》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/junshi/1241780.html




