最近,总有人留言询问JJF 1070-2005《定量包装商品净含量计量检测规则》。现在,我将根据JJF 1070-2005《定量包装商品净含量测量与测试规则》进行解释。 首先,提取标...

一.导言
本周共享的文献发表在11月22日的《科学国际医学》上,题为“靶向存根1-组织因子轴正常化甲亢确保Mic表型而不增加出血风险”,由波士顿大学医学院Vipul C. Chitalia研究小组完成。Vipul C. Chitalia的团队今年刚刚发现了一种新的作用蛋白-c-CBL,它可能会降解β-连环蛋白,使结直肠癌患者受益。紧接着,这篇文章发现了一个新的潜在的治疗靶点,叫做STUB1蛋白。作者证实STUB1的增加可以预防血栓形成,但不会延长肾病小鼠模型的出血症状,为肾病患者提供了一种新的可行的抗血栓治疗方法。
二、背景
慢性肾脏疾病患者的治疗存在许多问题,因为它们不仅增加了血管血栓形成的风险,而且在使用抗凝剂时更容易出现并发症。尽管吲哚尿毒症溶质和芳香烃受体与血栓形成相关因子之间的相关性已得到证实,但仍不能完全解释CKD驱动的血栓形成和随后出血风险的具体机制。
三.结果和方法
一个
吲哚盐酸盐以AHR和TF依赖的方式介导慢性肾脏病中甲状腺机能亢进性尿毒症表型的形成
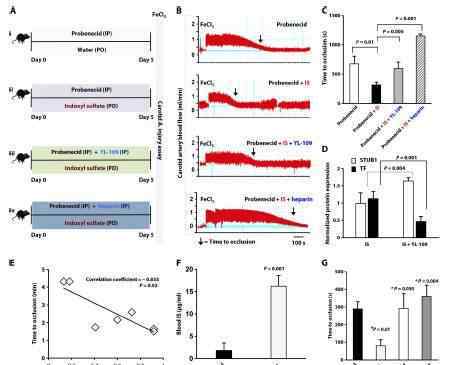
作者建立了一个可以概括高血栓性尿毒症表现型溶质特异性的动物模型。首先,基于吲哚盐酸盐可增强血栓形成的假设,作者开发了一种动物实验方案,并使用AHR衰减法检测接受吲哚盐酸盐和丙磺舒的小鼠血管中AHR的活化。这些数据表明血管壁中吲哚盐酸盐浓度的增加足以激活吲哚盐酸盐和丙磺舒暴露的小鼠的AHR-TF信号转导。在确定了动物血管壁的AHR-TF关系后,作者采用三氯化铁损伤和光损伤后血栓形成模型检测颈动脉血栓形成。所有这些结果表明,吲哚盐酸盐可以在整个慢性肾脏病谱中介导甲亢性尿毒症的形成。
2
AHR通过stub 1调节TF
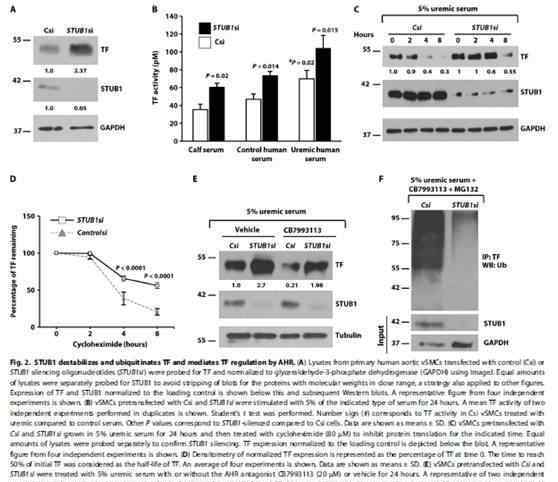
基于上述数据,我们知道吲哚盐酸盐是高血栓性尿毒症表型的一个强有力的因素,因此作者进一步探讨了吲哚盐酸盐诱导的AHR/TF变化的机制。研究发现STUB1、泛素连接酶和AHR相互作用,介导和影响IS/AHR对TF的调节。竞争性AHR拮抗剂降低TF表达80%,而TF表达在STUB1沉默中仅降低30%。STUB1敲除结果和STUB1突变体H260Q的WB结果也表明STUB1介导TF泛素化,AHR拮抗剂通过STUB1增加TF下调。
三
尿毒症时STUB1-TF相互作用是动态的
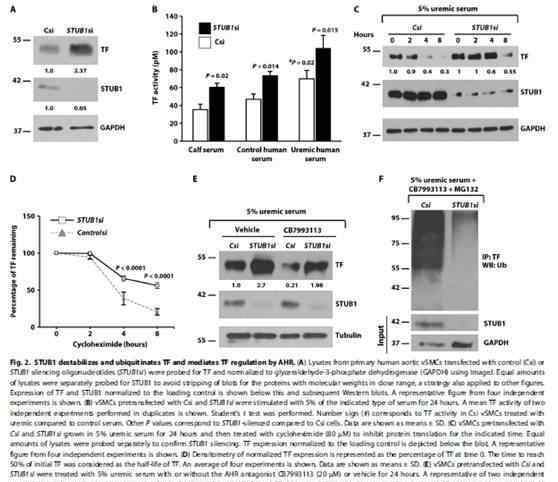
泛素是一个非线性过程,由一系列复杂的交叉指型步骤组成,包括泛素激活、偶联和泛素部分转移到靶分子。这个过程需要连接酶和它的假定靶之间精确和动态的相互作用。免疫沉淀、体外联合和免疫荧光联合AHR拮抗剂的结果表明,尿毒症降低了STUB1-TF与TF的相互作用,稳定了TF,AHR拮抗剂迅速恢复了相互作用。此外,STUB1与TF的相互作用位点也证实了上述结合模式。
四
人体组织中STUB1-TF之间的关系取决于尿毒症的发生
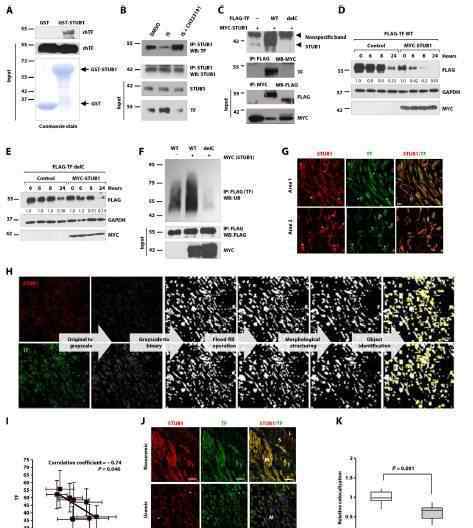
先前的研究表明,人类血管组织中的STUB1-TF是动态相互作用和调节的。根据这些数据,作者假设在尿毒症环境中STUB1和TF成反比,并开发了一种对象级强度估计算法来量化TF和STUB1表达式。结果表明,TF与动静脉畸形血管平滑肌中STUB1的表达呈负相关。因此,作者进一步假设吲哚盐酸盐诱导的血管平滑肌中STUB1-TF相互作用的减少可能减少了STUB1-TF在尿毒症血管壁中的共定位。此外,基于像素级分析的定制共定位算法被用于比较人尿毒症血管和非慢性肾病患者的STUB1-TF共定位。结果表明,与非人类血管相比,尿毒症患者STUB1-TF的共定位减少了近50%。总之,这些结果表明STUB1与TF的相互作用是直接的、动态的。
五
STUB1调节介入治疗后的血栓形成
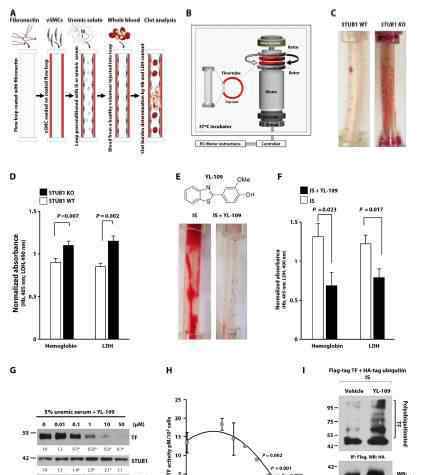
流动回路系统用于检查STUB1对血栓形成的影响。结果表明,STUB1的这些基因和药理学操作总是表明STUB1以细胞类型特异性的方式调节排列在血流环中的血管平滑肌细胞中的血栓形成。
六
IS-AHR-STUB1可以在不改变止血的情况下将高度血栓性尿毒症的表型逆转为非慢性肾病
接下来,作者用吲哚溶质特异性动物模型研究了增强的STUB1是否抑制了体内高血栓性尿毒症的环境。结果表明,通过STUB1的TF降低,甲亢性尿毒症的表型降低至非CKD范围。因为溶质特异性动物模型部分总结了尿毒症表型,这些结果需要在已建立的CKD模型中进一步验证。这两个独立的模型有力地表明,CKD是一个高血栓形成的环境,尿毒症引起的血栓形成被标准化到非CKD范围,也伴随着AHR-STUB1的调节。然后,作者使用标准尾静脉横断模型来权衡上述药物的抗血栓形成作用与出血风险。综合数据显示,与肝素不同,STUB1调节可以将吲哚盐酸盐介导的过表达改变为非血管表型,而不会增加出血风险。


一.导言
本周共享的文献发表在11月22日的《科学国际医学》上,题为“靶向存根1-组织因子轴正常化甲亢确保Mic表型而不增加出血风险”,由波士顿大学医学院Vipul C. Chitalia研究小组完成。Vipul C. Chitalia的团队今年刚刚发现了一种新的作用蛋白-c-CBL,它可能会降解β-连环蛋白,使结直肠癌患者受益。紧接着,这篇文章发现了一个新的潜在的治疗靶点,叫做STUB1蛋白。作者证实STUB1的增加可以预防血栓形成,但不会延长肾病小鼠模型的出血症状,为肾病患者提供了一种新的可行的抗血栓治疗方法。
二、背景
慢性肾脏疾病患者的治疗存在许多问题,因为它们不仅增加了血管血栓形成的风险,而且在使用抗凝剂时更容易出现并发症。尽管吲哚尿毒症溶质和芳香烃受体与血栓形成相关因子之间的相关性已得到证实,但仍不能完全解释CKD驱动的血栓形成和随后出血风险的具体机制。
三.结果和方法
一个
吲哚盐酸盐以AHR和TF依赖的方式介导慢性肾脏病中甲状腺机能亢进性尿毒症表型的形成
作者建立了一个可以概括高血栓性尿毒症表现型溶质特异性的动物模型。首先,基于吲哚盐酸盐可增强血栓形成的假设,作者开发了一种动物实验方案,并使用AHR衰减法检测接受吲哚盐酸盐和丙磺舒的小鼠血管中AHR的活化。这些数据表明血管壁中吲哚盐酸盐浓度的增加足以激活吲哚盐酸盐和丙磺舒暴露的小鼠的AHR-TF信号转导。在确定了动物血管壁的AHR-TF关系后,作者采用三氯化铁损伤和光损伤后血栓形成模型检测颈动脉血栓形成。所有这些结果表明,吲哚盐酸盐可以在整个慢性肾脏病谱中介导甲亢性尿毒症的形成。

2
AHR通过stub 1调节TF
基于上述数据,我们知道吲哚盐酸盐是高血栓性尿毒症表型的一个强有力的因素,因此作者进一步探讨了吲哚盐酸盐诱导的AHR/TF变化的机制。研究发现STUB1、泛素连接酶和AHR相互作用,介导和影响IS/AHR对TF的调节。竞争性AHR拮抗剂降低TF表达80%,而TF表达在STUB1沉默中仅降低30%。STUB1敲除结果和STUB1突变体H260Q的WB结果也表明STUB1介导TF泛素化,AHR拮抗剂通过STUB1增加TF下调。

三
尿毒症时STUB1-TF相互作用是动态的
泛素是一个非线性过程,由一系列复杂的交叉指型步骤组成,包括泛素激活、偶联和泛素部分转移到靶分子。这个过程需要连接酶和它的假定靶之间精确和动态的相互作用。免疫沉淀、体外联合和免疫荧光联合AHR拮抗剂的结果表明,尿毒症降低了STUB1-TF与TF的相互作用,稳定了TF,AHR拮抗剂迅速恢复了相互作用。此外,STUB1与TF的相互作用位点也证实了上述结合模式。

四
人体组织中STUB1-TF之间的关系取决于尿毒症的发生
先前的研究表明,人类血管组织中的STUB1-TF是动态相互作用和调节的。根据这些数据,作者假设在尿毒症环境中STUB1和TF成反比,并开发了一种对象级强度估计算法来量化TF和STUB1表达式。结果表明,TF与动静脉畸形血管平滑肌中STUB1的表达呈负相关。因此,作者进一步假设吲哚盐酸盐诱导的血管平滑肌中STUB1-TF相互作用的减少可能减少了STUB1-TF在尿毒症血管壁中的共定位。此外,基于像素级分析的定制共定位算法被用于比较人尿毒症血管和非慢性肾病患者的STUB1-TF共定位。结果表明,与非人类血管相比,尿毒症患者STUB1-TF的共定位减少了近50%。总之,这些结果表明STUB1与TF的相互作用是直接的、动态的。
五
STUB1调节介入治疗后的血栓形成
流动回路系统用于检查STUB1对血栓形成的影响。结果表明,STUB1的这些基因和药理学操作总是表明STUB1以细胞类型特异性的方式调节排列在血流环中的血管平滑肌细胞中的血栓形成。

六
IS-AHR-STUB1可以在不改变止血的情况下将高度血栓性尿毒症的表型逆转为非慢性肾病
接下来,作者用吲哚溶质特异性动物模型研究了增强的STUB1是否抑制了体内高血栓性尿毒症的环境。结果表明,通过STUB1的TF降低,甲亢性尿毒症的表型降低至非CKD范围。因为溶质特异性动物模型部分总结了尿毒症表型,这些结果需要在已建立的CKD模型中进一步验证。这两个独立的模型有力地表明,CKD是一个高血栓形成的环境,尿毒症引起的血栓形成被标准化到非CKD范围,也伴随着AHR-STUB1的调节。然后,作者使用标准尾静脉横断模型来权衡上述药物的抗血栓形成作用与出血风险。综合数据显示,与肝素不同,STUB1调节可以将吲哚盐酸盐介导的过表达改变为非血管表型,而不会增加出血风险。



一.导言
本周共享的文献发表在11月22日的《科学国际医学》上,题为“靶向存根1-组织因子轴正常化甲亢确保Mic表型而不增加出血风险”,由波士顿大学医学院Vipul C. Chitalia研究小组完成。Vipul C. Chitalia的团队今年刚刚发现了一种新的作用蛋白-c-CBL,它可能会降解β-连环蛋白,使结直肠癌患者受益。紧接着,这篇文章发现了一个新的潜在的治疗靶点,叫做STUB1蛋白。作者证实STUB1的增加可以预防血栓形成,但不会延长肾病小鼠模型的出血症状,为肾病患者提供了一种新的可行的抗血栓治疗方法。
二、背景
慢性肾脏疾病患者的治疗存在许多问题,因为它们不仅增加了血管血栓形成的风险,而且在使用抗凝剂时更容易出现并发症。尽管吲哚尿毒症溶质和芳香烃受体与血栓形成相关因子之间的相关性已得到证实,但仍不能完全解释CKD驱动的血栓形成和随后出血风险的具体机制。
三.结果和方法
一个
吲哚盐酸盐以AHR和TF依赖的方式介导慢性肾脏病中甲状腺机能亢进性尿毒症表型的形成
作者建立了一个可以概括高血栓性尿毒症表现型溶质特异性的动物模型。首先,基于吲哚盐酸盐可增强血栓形成的假设,作者开发了一种动物实验方案,并使用AHR衰减法检测接受吲哚盐酸盐和丙磺舒的小鼠血管中AHR的活化。这些数据表明血管壁中吲哚盐酸盐浓度的增加足以激活吲哚盐酸盐和丙磺舒暴露的小鼠的AHR-TF信号转导。在确定了动物血管壁的AHR-TF关系后,作者采用三氯化铁损伤和光损伤后血栓形成模型检测颈动脉血栓形成。所有这些结果表明,吲哚盐酸盐可以在整个慢性肾脏病谱中介导甲亢性尿毒症的形成。

2
AHR通过stub 1调节TF
基于上述数据,我们知道吲哚盐酸盐是高血栓性尿毒症表型的一个强有力的因素,因此作者进一步探讨了吲哚盐酸盐诱导的AHR/TF变化的机制。研究发现STUB1、泛素连接酶和AHR相互作用,介导和影响IS/AHR对TF的调节。竞争性AHR拮抗剂降低TF表达80%,而TF表达在STUB1沉默中仅降低30%。STUB1敲除结果和STUB1突变体H260Q的WB结果也表明STUB1介导TF泛素化,AHR拮抗剂通过STUB1增加TF下调。

三
尿毒症时STUB1-TF相互作用是动态的
泛素是一个非线性过程,由一系列复杂的交叉指型步骤组成,包括泛素激活、偶联和泛素部分转移到靶分子。这个过程需要连接酶和它的假定靶之间精确和动态的相互作用。免疫沉淀、体外联合和免疫荧光联合AHR拮抗剂的结果表明,尿毒症降低了STUB1-TF与TF的相互作用,稳定了TF,AHR拮抗剂迅速恢复了相互作用。此外,STUB1与TF的相互作用位点也证实了上述结合模式。

四
人体组织中STUB1-TF之间的关系取决于尿毒症的发生
先前的研究表明,人类血管组织中的STUB1-TF是动态相互作用和调节的。根据这些数据,作者假设在尿毒症环境中STUB1和TF成反比,并开发了一种对象级强度估计算法来量化TF和STUB1表达式。结果表明,TF与动静脉畸形血管平滑肌中STUB1的表达呈负相关。因此,作者进一步假设吲哚盐酸盐诱导的血管平滑肌中STUB1-TF相互作用的减少可能减少了STUB1-TF在尿毒症血管壁中的共定位。此外,基于像素级分析的定制共定位算法被用于比较人尿毒症血管和非慢性肾病患者的STUB1-TF共定位。结果表明,与非人类血管相比,尿毒症患者STUB1-TF的共定位减少了近50%。总之,这些结果表明STUB1与TF的相互作用是直接的、动态的。
五
STUB1调节介入治疗后的血栓形成
流动回路系统用于检查STUB1对血栓形成的影响。结果表明,STUB1的这些基因和药理学操作总是表明STUB1以细胞类型特异性的方式调节排列在血流环中的血管平滑肌细胞中的血栓形成。

六
IS-AHR-STUB1可以在不改变止血的情况下将高度血栓性尿毒症的表型逆转为非慢性肾病
接下来,作者用吲哚溶质特异性动物模型研究了增强的STUB1是否抑制了体内高血栓性尿毒症的环境。结果表明,通过STUB1的TF降低,甲亢性尿毒症的表型降低至非CKD范围。因为溶质特异性动物模型部分总结了尿毒症表型,这些结果需要在已建立的CKD模型中进一步验证。这两个独立的模型有力地表明,CKD是一个高血栓形成的环境,尿毒症引起的血栓形成被标准化到非CKD范围,也伴随着AHR-STUB1的调节。然后,作者使用标准尾静脉横断模型来权衡上述药物的抗血栓形成作用与出血风险。综合数据显示,与肝素不同,STUB1调节可以将吲哚盐酸盐介导的过表达改变为非血管表型,而不会增加出血风险。


:bjtu001,提交邮件:1730586832@qq.com DF4——西瓜 DF4B—-橙色 DF4C——乌克兰猫、蓝猫 DF4D—-老虎、花虎、乌克兰虎、绿虎 DF5—-5号,魔法 DF7C—-七夕 DF7G—...
:bjtu001,提交邮件:1730586832@qq.com DF4——西瓜 DF4B—-橙色 DF4C——乌克兰猫、蓝猫 DF4D—-老虎、花虎、乌克兰虎、绿虎 DF5—-5号,魔法 DF7C—-七夕 DF7G—...
:bjtu001,提交邮件:1730586832@qq.com DF4——西瓜 DF4B—-橙色 DF4C——乌克兰猫、蓝猫 DF4D—-老虎、花虎、乌克兰虎、绿虎 DF5—-5号,魔法 DF7C—-七夕 DF7G—...













