吲哚青绿(ICG)可用于评估肝脏储备功能、肝切除术中荧光成像导航技术、前哨淋巴结活检、胆道成像、组织血液灌注评估以及靶向治疗的中介。事实上,ICG最重要的作用是评估肝脏储备功能。
作者是王力军
资料来源:北京大学肿瘤医院肝胆外科
如今,结直肠癌肝转移的手术切除已成为根治性治疗的金标准。然而,由于肿瘤的数量和大小,肝转移的初始可切除比例小于20%。从肿瘤学的角度来看,大量结直肠癌肝转移患者需要术前化疗。对于接受过化疗的患者,需要进一步评估化疗所致肝损伤的严重程度及其对围手术期安全性的影响。
在本课题中,我将介绍ICG试验在肠癌肝转移患者术前化疗评估中的作用。
一个
ICG试验反映肝脏储备功能的原理
静脉注射ICG后,血浆白蛋白,α,?脂蛋白结合,随着肝血流进入肝窦,被肝细胞快速有效地吸收,然后从肝细胞以游离形式分泌到胆汁中。与胆红素代谢不同,ICG代谢没有肠肝循环。在体内,ICG被具有一级动力学的肝细胞消除,即被指数函数衰减。连续测量可以描绘出血中ICG浓度的曲线,该曲线最初显示接近直线的下降,并在15分钟后逐渐趋于平坦。因此,临床上通常使用ICG 15分钟滞留率(ICG-R15)来反映肝脏排泄功能和储备功能。一般来说,ICG-r15

图1。上图中肝小叶的结构和功能可能导致ICG异常
二
化疗后肝损伤的分类
对于肝转移患者,化疗所致肝损伤的发生率与化疗周期、化疗方案、BMI等因素密切相关,其真实发生率难以获得。文献报道发生率在30 ~ 40%左右,但不同中心不同患者肝损伤严重程度不同,结论不能一概而论。
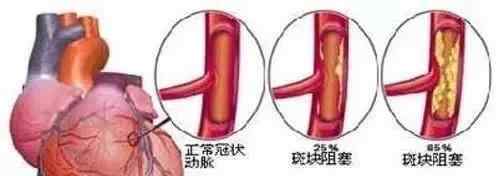
一般来说,肠癌肝转移化疗相关的损伤有三种类型。其中奥沙利铂可引起肝窦阻塞综合征(SOS),表现为肝窦扩张充血、静脉纤维化和闭塞。5-FU可导致肝脂肪变性,现已被归类为非酒精性脂肪性肝病。非酒精性脂肪肝的共同特点是肝细胞肿胀、不良脂质体形成和糖原合成障碍。非酒精性脂肪性肝炎(Nash)是一种严重的非酒精性脂肪性肝病,其特征是严重的肝脏脂肪变性、肝脏炎性细胞浸润和肝细胞的气球样变性。文献报道伊立替康可能与这种类型的化疗损伤有关。


图2。上图是SOS,下图C是单纯性肝脂肪变性,d是脂肪性肝炎。
三
ICG异常与化疗性肝损伤的关系
从临床角度来看,由于肝脏储备功能强大,对于以前没有接受过化疗的普通人来说,绝大多数ICG-R15值都在正常范围内(重度肥胖或其他肝病除外)。与肝硬化等永久性肝小叶损伤相比,化疗引起的肝损伤是一个动态过程,有些损伤是可逆的,因此对这一部分的研究存在争议。
彼得-迈克尔·克里格分析了该中心101名CRLM患者的数据。化疗组平均ICG-R15为7.3%,非化疗组为3.5%。化疗组每分钟ICG清除率为19.3%,低于非化疗组的23.4%。
成田正人分析了中心98例患者的资料,其中ICG-r15 > 10%组50例,其中术前化疗比例高达90%;ICG-R15 & lt;10%组48例,其中术前化疗率为72.9%,两组有统计学差异。这些结果表明术前化疗可能导致ICG-R15升高。
当然,也有研究没有明显不同。根据Kiyokazu Hiwatashi的研究,化疗组患者的平均ICG-R15为9.77%,而非化疗组为8.68%。两组无显著性差异。
四
ICG异常与化疗引起的肝损伤的严重程度相符吗?
先前的研究表明肝硬化患者的正弦毛细血管化与ICG增加有关。然而,CD34分子在异常的肝窦上皮细胞中表达。
成田正夫在他的研究中试图探索ICG价值增加的可能机制。结果显示,98例患者中,38例出现SOS,其中28例ICG升高,10例ICG正常,差异有统计学意义。有人认为,紧急呼救与ICG增加有关。ICG升高组CD34分子表达明显高于ICG正常组(81.2 vs.32.3x10^4像素)。进一步的亚组分析显示,SOS评分为0、1、2和3的患者ICG-R15平均值分别为9.1%、10.2%、13.0%和23.2%,CD34分子的表达也逐渐增加。提示ICG-R15与SOS评分显著相关,且随着SOS评分的增加,CD34和ICG-R15的表达增加。
然而,ICG和经病理学证实的化疗诱导的肝损伤之间的一致性尚未在其他研究中得到证实。
本研究纳入了94例接受肝切除术的CRLM患者的临床病理资料,并对所有患者进行术前化疗,以评估ICG-R15与病理评分的关系。其中Si(窦钠醛注射液)分为0分(无)和1 ~ 3分(轻中度至重度),SH(脂肪性肝炎)根据NAFLD评分分为0 ~ 5分。结果阴性组和阳性组术前ICG-R15值无显著性差异,无论是SI还是SH。同样,在相关性分析中,术前ICG-R15与SI病理评分无强相关性,ICG-R15与NAFLD评分无相关性。在Takeshi Takamoto的研究中,异常ICG值与化疗引起的肝损伤程度不完全匹配。
对上述争议的分析可能是由于纳入案例的选择性。从安全性的角度来看,ICG明显异常(如>:30%)的患者,由于围手术期肝功能异常或死亡风险高,可能不会接受手术,因此这部分高危人群的数据缺失,因此在这一类别中的分析可能不会得到积极的差异。
五
ICG异常会影响运营安全吗?
虽然ICG-R15指数与化疗所致肝损伤的严重程度无明显匹配,但许多回顾性研究发现,ICG指数的异常与围手术期并发症的发生有关。
在彼得-迈克尔·克里格的研究中,ICG-R15升高组术后平均住院时间为10.6天,而ICG-R15正常组为7.9天。前者术后并发症发生率为39.1%,后者仅为12.8%。在锁骨下动脉三期和四期术后并发症中,ICG异常组的比例也较高。结果表明,ICG试验有助于确定新辅助化疗后患者的肝损伤,并评估肝切除术后并发症的风险。
Kiyokazu Hiwatashi的研究还发现,ICG R-15值的增加是肝切除术后和多周期化疗(>:6个周期)后并发症的预测因子,是肝功能损害的预测因子。
Hiroshi Nakano发现术前奥沙利铂化疗≥6个周期且AST >: 36IU/L和ICG-r15 >: 10%是肝窦阻塞综合征的高危因素,进一步导致并发症增加和住院时间延长。
然而,小森弘治的研究发现,尽管术前FOLFOX方案化疗可导致肝功能下降,但不会增加围手术期并发症和死亡率。
由于影响肝切除术后并发症的因素不仅有肝脏储备功能,还有手术技术、围手术期处理等因素,ICG试验是帮助评估肝切除术后并发症风险的重要方法,但不是唯一的因素。
六
ICG异常可以恢复吗?
对于同一个病人,ICG值在治疗过程中并不是一成不变的,有时甚至波动很大。下面是Makuuchi的一篇经典文章,旨在探讨术前采用folffox/FOLFIRI方案化疗的患者,其ICG-R15的变化与化疗周期及间歇时间的关系。结果表明:

图例:在整个患者组中,与化疗后0-2周相比,ICG R15的平均值随着停止化疗后间隔时间的延长而增加(2-4w,4-8w和>:8w)逐渐降低(P

图例:对21例患者进行多次复测,结果显示随着化疗间隔时间的延长,ICG 15的平均值从17.7%下降到11.6%(P = 0.001),在最初的ICG 15 >中观察到:可观察到10%的患者。这一结果表明,经过6个多周期的化疗后,ICG的增加可以通过“等待”策略得到一定程度的恢复。
七
总结
ICG试验是评价肝脏储备功能的重要方法,为化疗患者的肝功能指标提供了科学、定量的监测方法,为手术决策、治疗时机和围手术期风险评估提供了选择依据。但由于化疗后肝损伤的程度和过程是动态变化的,临床实践中没有公认的、量化的流程图来指导大肠癌患者化疗后ICG指数、肝切除耐受度与并发症发生率的关系,这也是今后该领域的热点和难点!
1.《icg 化疗性肝损伤:ICG能帮外科医生做些什么?》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《icg 化疗性肝损伤:ICG能帮外科医生做些什么?》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/yule/797821.html