古贺健康原创
每天说话晚,不看书,不开心,不都是我们的错。也可能是肠道菌群有问题。肠道菌群不仅影响消化吸收,还影响神经系统。近年来,科学家发现肠道细菌可能在神经发育、焦虑和抑郁,甚至许多中枢神经系统疾病中起重要作用。
什么是肠道菌群
首先,我们来了解一下肠道菌群。
肠道菌群包含了约100万亿个生活在胃肠道的微生物的集体基因组,我们肠道细菌的基因库包含了比人类基因组多150倍的独特基因。
在人类定居的众多微生物群落中,肠道菌群正成为影响宿主健康状况的主要参与者。肠道菌群的组成是在宿主发育的早期建立的,在生命中可以经历许多变化。越来越多的证据表明肠道微生物群与中枢神经系统有关。
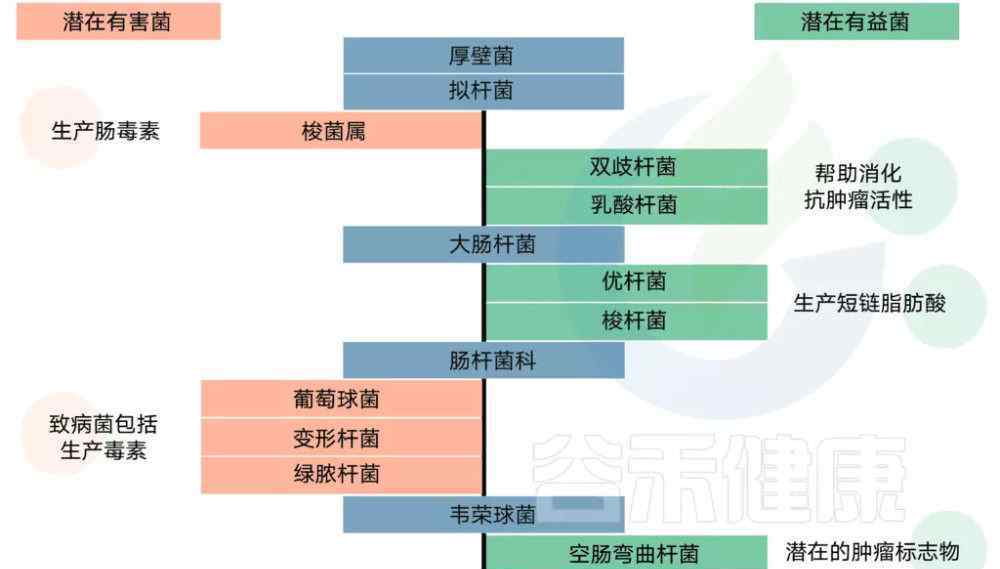 Ghaisaset al.Pharmacology & therapeutics, 2016 Ghaisaset al .药理学& amp治疗学,2016
Ghaisaset al.Pharmacology & therapeutics, 2016 Ghaisaset al .药理学& amp治疗学,2016
肠道菌群与我们的发育同步
是陪伴和影响我们一生的伴侣
它会影响我们怀孕后的神经发育
神经发育过程
发现神经发育的主要过程与母亲和新生儿肠道微生物的变化相一致
 Sharonet al.Cell, 2016 Sharonet等人,2016年
Sharonet al.Cell, 2016 Sharonet等人,2016年
肠-脑轴参与早期婴儿神经发育和感知
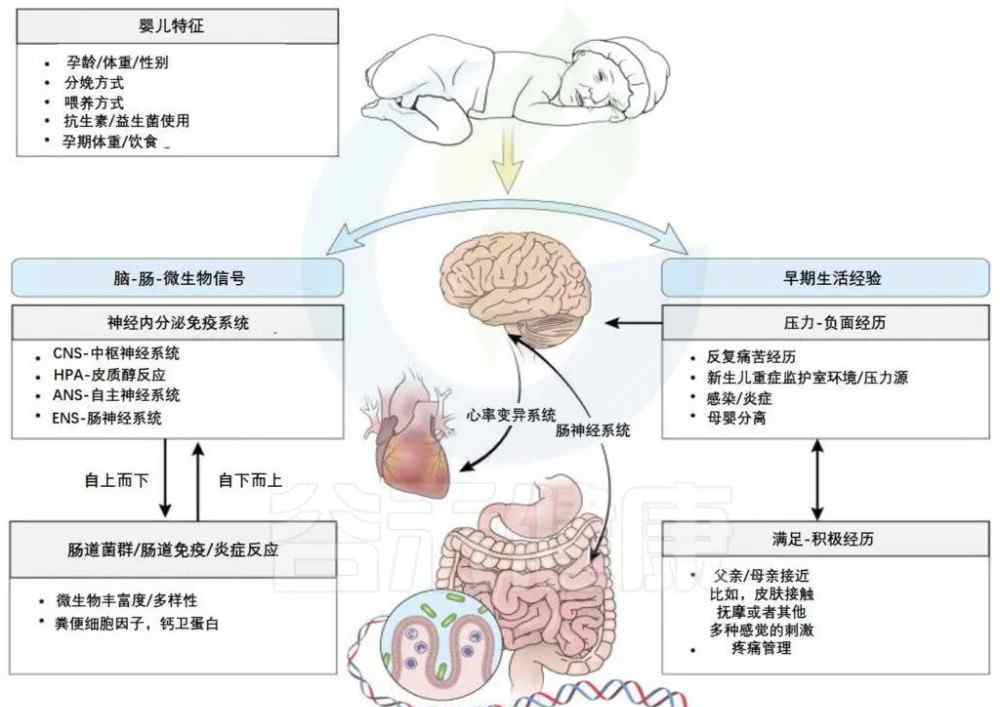
丛等.新生儿护理进展:全国新生儿护士协会官方期刊,2015
接下来,我们来看看胃肠道是如何构成的
胃肠道成分
胃肠道长度5米,上皮表面积约32平方米。它是体内70-80%免疫细胞的家园,有1亿多个神经元和多达10万个外部神经末梢。
微生物群包含多达40万亿个细胞和至少数百种不同的物种。胃肠道的一个重要功能是感知和响应外部线索。
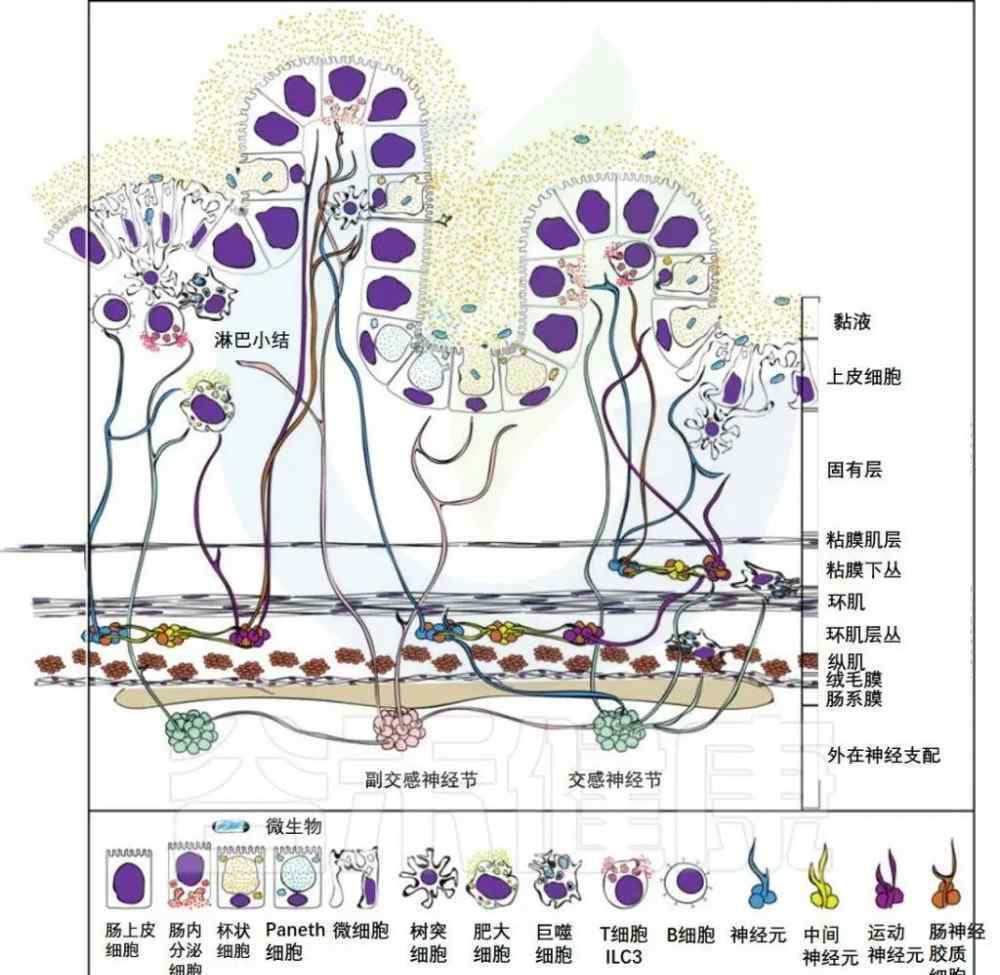
胃肠道由横截面不同的隔间组成。在外部,交感神经和副交感神经纤维通过肠系膜进入胃肠道,并可延伸至肠组织的所有层。各种免疫细胞驻留在肌肉层,但在固有层也很丰富,尤其是在佩耶氏斑块和淋巴滤泡中。
这些免疫细胞也与神经元和胶质细胞密切相关。这里显示的上皮由五种不同的细胞类型组成,包括吸收性肠上皮细胞、肠内分泌细胞、杯状细胞、潘氏细胞和微细胞。
胃肠道对营养物质的吸收、粘膜和全身免疫反应的诱导以及健康肠道菌群的维持至关重要。
你会发现不仅仅是消化细胞
还有大量的神经元和免疫细胞
和大量的肠道菌群
为什么会有这么一句话
“胃不好,心情不好,脑子不好”?
肠道和大脑是如何连接的
从而影响神经系统?
经过大量的研究,我们逐渐发现了肠道菌群和大脑之间的联系。
肠脑轴
人类肠道微生物群在许多方面影响人类大脑健康:
结构性细菌成分如脂多糖为先天免疫系统提供低水平的滋补刺激。细菌生态失衡、小肠细菌过度生长或肠道通透性增加引起的过度刺激可能会产生全身和/或中枢神经系统炎症。
细菌蛋白可能与人类抗原发生交叉反应,可能刺激适应性免疫系统的功能障碍。
细菌酶可以产生D-乳酸、氨等神经毒性代谢产物,甚至短链脂肪酸等有益代谢产物也可能发挥神经毒性。
肠道微生物可以产生与人类相同的激素和神经递质。这些激素的细菌受体影响微生物的生长和毒性。
肠道细菌直接刺激肠道神经系统的传入神经元,通过迷走神经向大脑发送信号。通过这些不同的机制,肠道微生物塑造了睡眠的结构和下丘脑-垂体-肾上腺轴的应激反应。它们影响记忆、情绪和认知,并在临床和治疗上与一系列疾病相关,包括酒精中毒、慢性疲劳综合征、纤维肌痛和不宁腿综合征。
 Wang and Kasper.Brain, behavior, and immunity, 2014 王和卡斯帕。大脑、行为和免疫,2014
Wang and Kasper.Brain, behavior, and immunity, 2014 王和卡斯帕。大脑、行为和免疫,2014
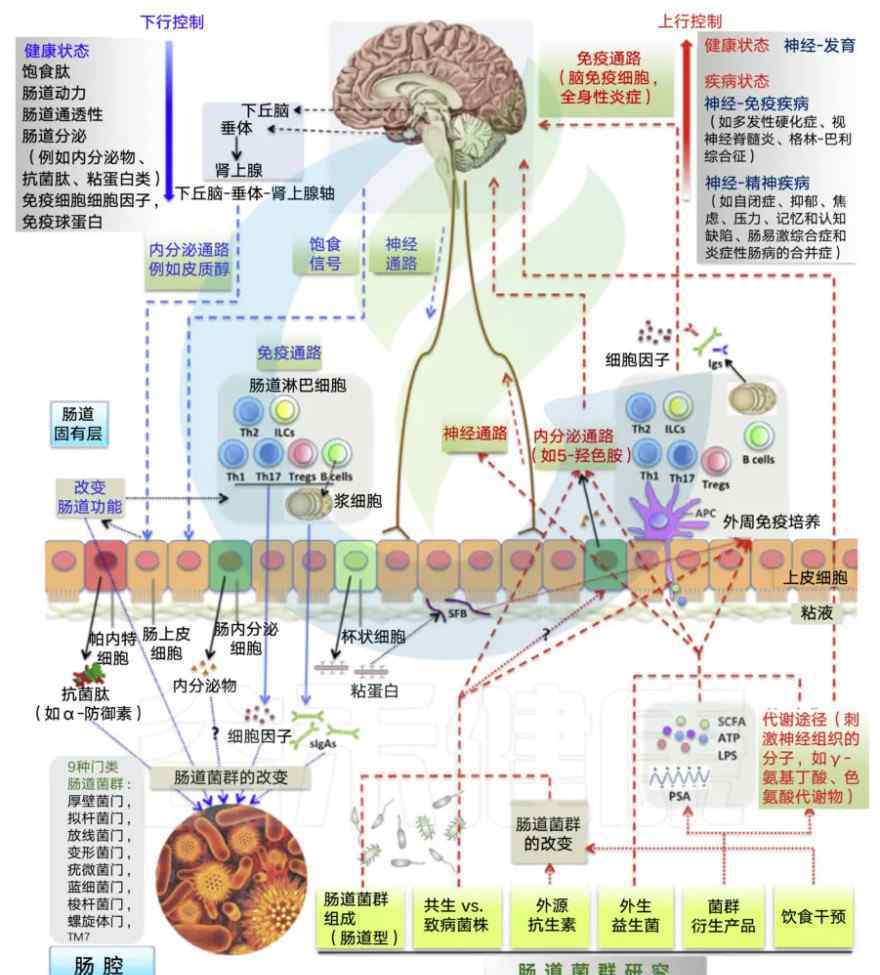
在健康和疾病的背景下,有许多方式引导着微生物群-肠-脑轴的向下和向上方向。
向下,中枢神经系统通过影响营养的可用性、饱食信号肽、影响肠道功能和神经通路的内部分泌来控制肠道微生物组成。
皮质醇的HPA轴释放调节肠道运动和完整性。
免疫途径可以打开,以应对肠道功能的变化。内分泌和神经通路也可以调节专门的肠上皮细胞的分泌,包括潘氏细胞、肠内分泌细胞和杯状细胞。它们的分泌产物影响植物群的生存和生活环境。
向上,肠道微生物群通过神经、内分泌、代谢和免疫途径控制中枢神经系统的活动。
菌群影响健康状态和疾病状态下的中枢神经系统。肠道菌群、其产物用APC采样,SFB(肠道丝状真菌)附着于上皮细胞介导的外周免疫培养。
肠道微生物的组成、菌群中的特定菌株、益生菌处理、菌群衍生产品等因素构成了微生物组研究的范围。
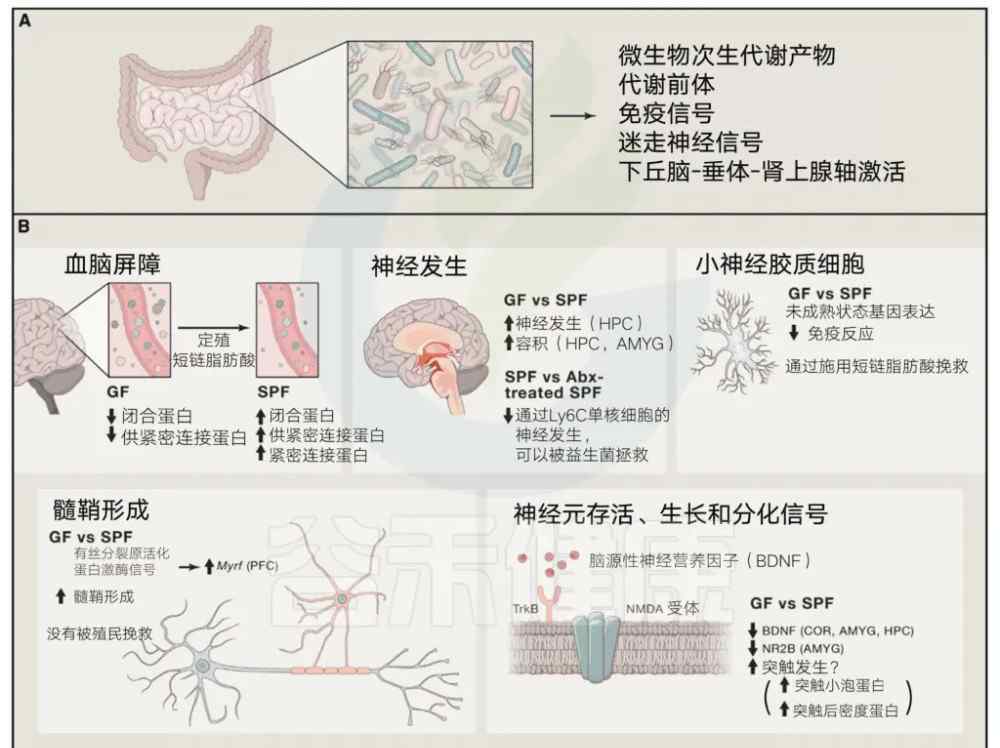
由肠道微生物及其产品直接或间接驱动的基本开发过程
 Sharonet al.Cell, 2016 Sharonet等人,2016年
Sharonet al.Cell, 2016 Sharonet等人,2016年
肠道微生物通过各种直接和间接的机制向大脑传递信息。
基因神经发育由绿色荧光动物的定居或抗生素对肠道细菌的消耗来调节。具体而言,调节以下过程:血脑屏障形成和完整性、神经发生、小胶质细胞的成熟和分化、髓鞘形成以及神经营养因子、神经递质及其各自受体的表达。
细分下来,肠神经系统是肠道的大脑,也与肠道的内外微环境相连。
肠神经系统
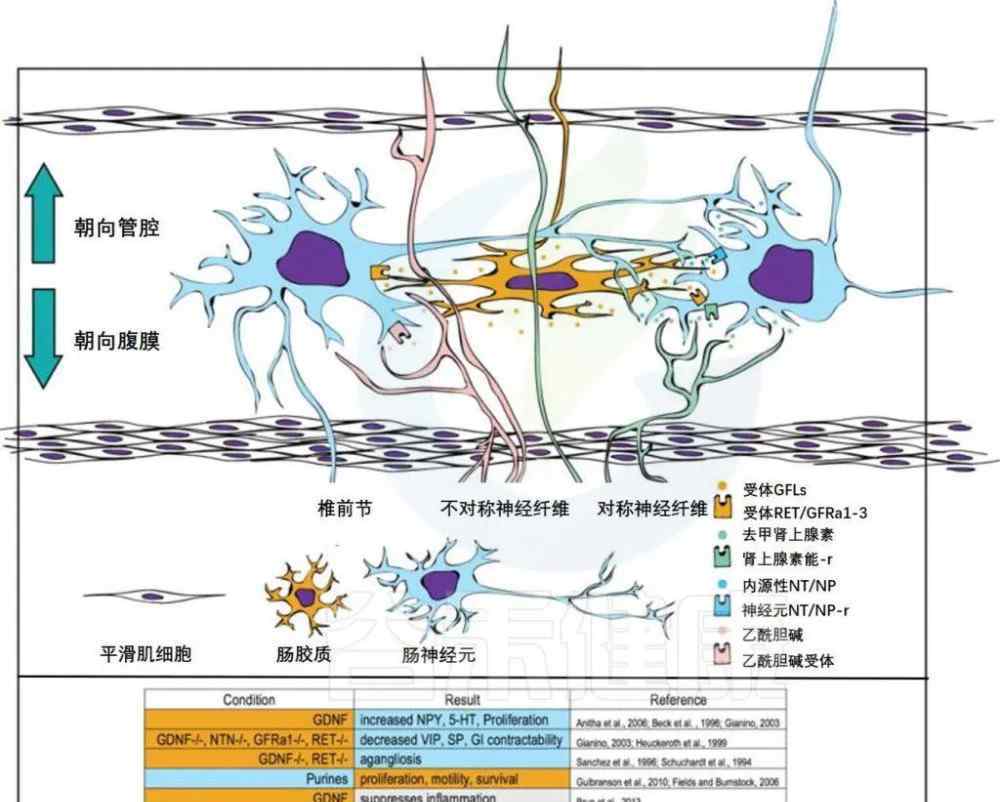
胃肠生理学的关键方面由肠神经系统控制。ENS由神经元和胶质细胞组成。
肠神经元位于粘膜下层或肌间丛。两个团块都位于两个肌肉层之间。副交感神经纤维释放乙酰胆碱,交感神经释放去甲肾上腺素。这些外部神经纤维可以支配肠神经元,但也与平滑肌、固有层和上皮细胞有关。肠道神经元可以神经支配或延伸到固有层,某些肠道真菌可以突触到交感神经节。
肠神经胶质细胞产生并释放神经营养因子,与肠神经元结合并延伸至整个粘膜。左边和中间的列用颜色编码,分别代表产生特定条件的细胞和分子以及这些特定条件的结果。
肠神经元和神经胶质细胞之间的联系
 Yoo and Mazmanian.Immunity, 2017 Yoo和Mazmanian。豁免,2017
Yoo and Mazmanian.Immunity, 2017 Yoo和Mazmanian。豁免,2017
此外,肠道菌群最终通过释放不同物质,干扰免疫系统,影响血脑屏障和中枢神经系统。
肠道用于收集营养和能量,防止有害毒素和病原体,清除废物。它是一个高度动态的环境,受蠕动周期性波动的影响。这些功能主要由两个肠道神经系统和数亿个驻留在肠道内的共生细菌来调控。对斑马鱼的研究表明,ENS调节肠道微生物群落的成员以维持肠道健康。通过施用代表性的抗炎细菌菌株或恢复ENS功能来预防ENS突变体中的炎症。
肠脑沟通途径
肠道菌群与大脑之间可能存在五种通讯通道,包括肠道神经网络、神经内分泌-HPA轴、肠道免疫系统、肠道菌群合成的一些神经递质和神经调节剂,以及包括肠道黏膜屏障和血脑屏障在内的屏障。在这个通讯网络中,大脑影响肠道运动、感知和分泌,来自肠道的内脏信号也影响大脑功能。
肠道菌群与大脑之间五种可能的沟通途径
 Wang H X, Wang Y P,Chinese medical journal, 2016 王海x,王永平,中华医学杂志,2016
Wang H X, Wang Y P,Chinese medical journal, 2016 王海x,王永平,中华医学杂志,2016
神经递质和代谢物
许多肠道菌群可以代谢并产生大量的神经递质及其类似物。此外,肠道菌群的一些代谢产物也可以通过免疫系统影响神经系统。
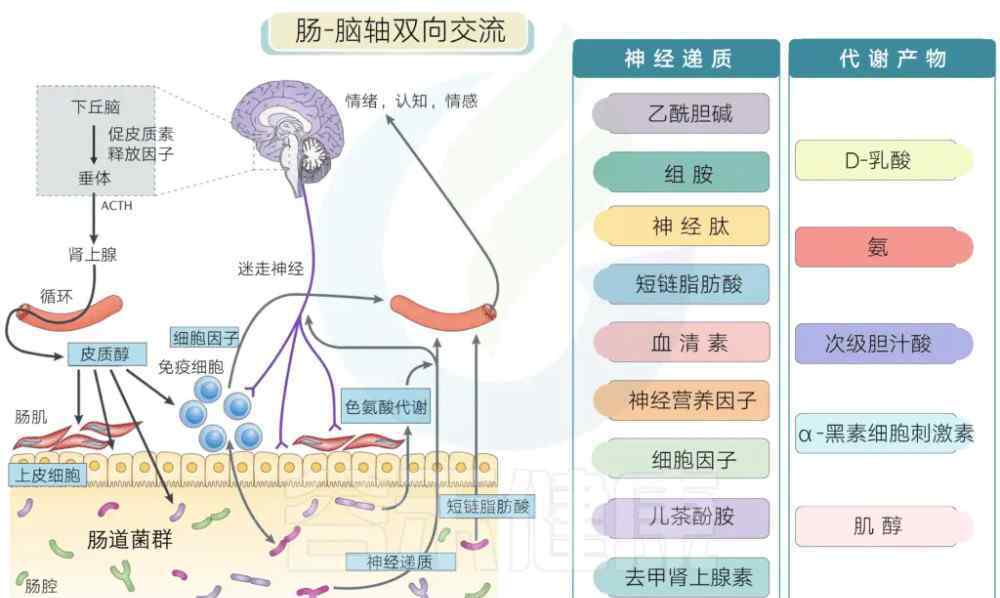 Cryan & Dinan,Nature reviews neuroscience, 2012 克莱恩&。迪南,《自然评论神经科学》,2012年
Cryan & Dinan,Nature reviews neuroscience, 2012 克莱恩&。迪南,《自然评论神经科学》,2012年
连接植物群和大脑
这也离不开一个重要的渠道
-血脑屏障
越来越多的血脑屏障证据表明,菌群与中枢神经系统相互作用,可以调节其多种功能。这种相互作用的一个机制是在血脑屏障的水平上。细菌可以直接将因子释放到体循环中,也可以转移到血液中。一旦进入血液,微生物群及其因子可以改变外周免疫细胞,促进与BBB的相互作用,最终与神经血管单位的其他元素相互作用。在菌群的影响下,细菌及其因子或外周部分释放的细胞因子可以通过BBB,改变BBB完整性,改变BBB转运速率,或诱导屏障细胞释放神经免疫物质。来自菌群的代谢产物,如短链脂肪酸,可以通过BBB影响大脑功能。通过这些和其他机制,微生物-BBB相互作用可以影响疾病的进展。
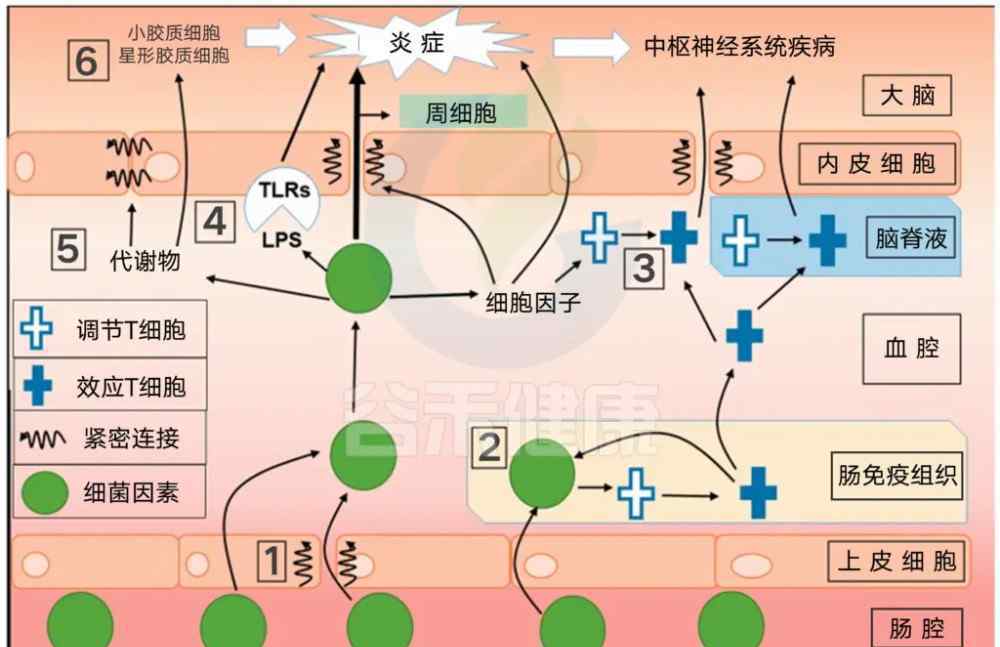
实验生物学和医学,2018
图中1层
菌群与全身免疫细胞沟通,可影响血脑屏障和中枢神经系统功能。肠腔不断暴露在外部环境的细菌中。肠上皮屏障的破坏可使肠道菌群进入固有层而不受调节。
图中2层
细菌可以穿透GALT(肠道相关淋巴组织)和血腔,与包括T细胞在内的各种免疫细胞相互作用。
图中三层
一些细菌可以刺激效应T细胞的分化。调节性T细胞测量GALT局部菌群变化,血液和脑脊液可促进T细胞脑浸润。
图中四层
循环细菌可以上调炎症细胞因子的水平,影响BBB的完整性,促进神经炎症。脂多糖由细菌因子产生,可作用于内皮TLR,促进神经炎症和中枢神经系统疾病。
图中五层
细菌代谢产物可以上调紧密连接蛋白,提高BBB完整性。
图中六层
代谢物也可以通过BBB影响胶质细胞和神经炎症。微生物群对周细胞的影响尚不清楚。
如果肠道菌群改变,
会带来哪些神经系统疾病和问题?
与神经系统疾病相关的细菌
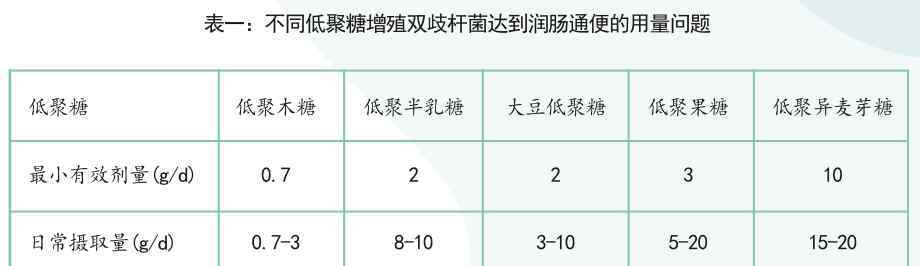
目前已经发现了一些与神经系统疾病研究相关的细菌。研究发现,这些疾病患者体内的一些菌群数量发生了明显的变化,如下表所示:
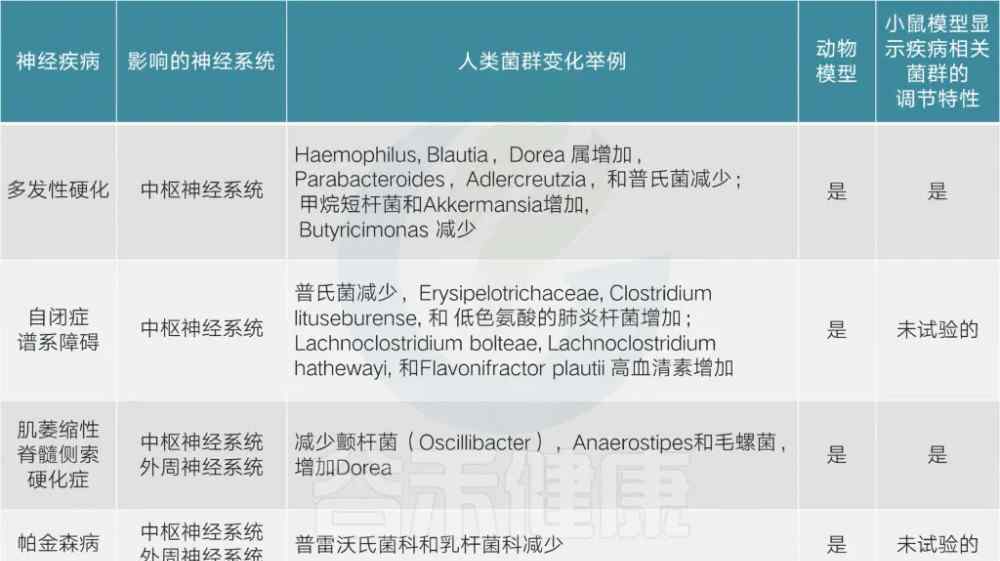 Mariettaet al., Neurotherapeutics, 2018 Mariettaet等人,《神经治疗学》,2018年
Mariettaet al., Neurotherapeutics, 2018 Mariettaet等人,《神经治疗学》,2018年
菌群干扰或异常引起的问题
目前,越来越多的证据表明,肠道菌群在引导和促进大脑发育方面发挥着重要作用,并对健康产生长期影响。
植物群和植物群产品的干扰将影响小鼠模型和人类行为
产前效应

产后效应



 Sharonet al.Cell, 2016 Sharonet等人,2016年
Sharonet al.Cell, 2016 Sharonet等人,2016年
注:GF-无菌;Abx:抗生素;无特异性病原体;
VTA:腹部覆盖区;PVN——下丘脑室旁核
SCFA:短链脂肪酸;ANS:自主神经系统;
NR2B:N-甲基-D-天冬氨酸受体亚单位2B;
菌群如何影响中枢神经系统疾病
免疫介导的中枢神经系统疾病
多发性硬化
多发性硬化(MS)是一种中枢神经系统慢性脱髓鞘疾病,由中枢神经系统自身免疫攻击介导。这是通过研究患者和使用被称为实验性自身免疫性脑脊髓炎的MS动物模型来实现的。
正如在一系列研究中观察到的,用单一细菌或细菌混合物进行口服治疗可以调节EAE病。益生菌动物双歧杆菌减少大鼠EAE模型中症状的持续时间。
乳杆菌,单独给药或与其他双歧杆菌菌株联合给药,通过调节促炎细胞因子和抗炎细胞因子的反应,倾向于缓解小鼠的EAE症状。
脆弱拟杆菌和乳酸片球菌的益生菌治疗也显著降低了小鼠对EAE的易感性。
视神经脊髓炎
视神经脊髓炎是一种中枢神经系统自身免疫性疾病,其特征是免疫介导的视神经和脊髓脱髓鞘。
发现水通道蛋白血清阳性的NMO和NMO家系患者的胃肠道抗原和抗体水平高于健康对照组,提示NMO患者的微生物种群组成和免疫状态发生了变化。
格林-巴利综合征
格林-巴利综合征是一种外周神经系统的自身免疫性疾病。
空家禽体内弯曲杆菌发现的肠道共生种是食物污染引起人类肠炎的主要原因。研究表明,弯曲杆菌肠炎患者有较高的GBS风险。
此外,弯曲杆菌与GBS的几种病理形式有关。不同的弯曲杆菌菌株和宿主因素在GBS的发展中起着重要的作用。
因此,空大肠弯曲杆菌代表一种介导神经自身免疫的肠道相关病原体。
其他免疫介导的疾病
脑膜炎是中枢神经系统保护膜的炎症。病毒或细菌感染可能导致脑膜炎。据报道,成人肠道共生大肠杆菌K1可从母亲转移到新生儿,引起脑膜炎。
慢性疲劳综合征,也称为肌痛性脑脊髓炎,仍不清楚。推测共生菌转运增加可能是部分CFS患者疾病活动的原因。
非免疫介导的中枢神经系统疾病
孤独症
自闭症谱系障碍是一系列以社会交往和沟通受损为特征的发育性神经行为障碍。新的数据表明,肠道微生物群与ASD之间存在关系,这可能是直接的因果关系,也可能是非典型喂养和营养模式的间接结果。
肠道菌群的破坏可能会促进产生神经毒素的细菌过度定居,导致自闭症症状。据报道,自闭症儿童的粪便样本中属于梭状芽孢杆菌的物种较多,拟杆菌门和厚壁菌门之间的不平衡也表现在自闭症儿童身上。
此外,其他肠道共栖动物,包括双歧杆菌、乳酸杆菌、苏特氏菌、真理报、乳球菌和产碱杆菌科的水平变化与自闭症有关。
肠道菌群介导的代谢也能影响自闭症。
抑郁症
抑郁症是由神经精神障碍或免疫障碍引起的情感障碍的主要形式。益生菌疗法已被证明能抑制动物抑郁模型。乳杆菌属下的物种被表征为抗抑郁药,并且含有鼠李糖乳杆菌和瑞士乳杆菌菌株的益生菌混合物可以通过使皮质酮水平正常化来改善由母体分离引起的抑郁。
同样,鼠李糖乳杆菌菌株JB-1通过以迷走神经依赖性方式调节皮质酮和GABA受体来减少抑郁症相关行为。
双歧杆菌也是有效的抗抑郁药。
大鼠强迫游泳试验和母体分离模型表明,婴儿双歧杆菌降低抑郁。其机制包括降低促炎细胞因子、调节色氨酸代谢和中枢神经系统神经递质。
此外,含有高水平多不饱和脂肪酸n-3的饮食配方通过类似于瑞士乳杆菌和长双歧杆菌的机制减轻了大鼠心肌梗塞后的抑郁。
焦虑和压力
焦虑和压力是具有神经、内分泌和免疫基础的情感障碍的常见形式。暴露于化学、生物或环境刺激等压力因素会引发压力和焦虑反应,包括HPA轴的激活。如前所述,焦虑和压力的共病在严重和轻度肠功能障碍类型中被认为是重要的,强调了肠脑信号如神经递质和免疫因子的作用。
与肠道菌群正常的SPF小鼠相比,GF小鼠表现出增加的运动活性和降低的焦虑。这种行为表型与绿色荧光小鼠中枢神经系统中较高水平的神经递质和突触长期增强减少有关。
后来的研究证实了在GF作用下焦虑样行为的减少,这可以用其他神经化学变化来解释,比如神经递质受体减少,色氨酸代谢增加。因此推测肠道菌群调节HPA轴的设定点。
有益益生菌可以改善焦虑。乳酸菌和双歧杆菌的特定物种具有抗焦虑作用。在动物焦虑模型中,分别或联合使用长双歧杆菌、婴儿双歧杆菌、里氏乳杆菌或鼠李糖乳杆菌来使行为表型正常化。
farciminis乳杆菌还抑制应激诱导的肠渗漏,并减弱HPA轴应激反应。
由瑞士乳杆菌和长双歧杆菌组成的益生菌制剂显示出对大鼠的抗焦虑活性和对健康受试者的有益心理作用。
疼痛
益生菌对微生物群的调节可以减轻周围神经对刺激的反应和对中枢神经系统的信号转导引起的伤害性疼痛。抗伤害感受性作用可见于乳酸菌种。
罗伊乳酸杆菌还能减轻CRD引起的正常大鼠内脏痛。
长度帕拉赛使受抗生素干扰的小鼠的CRD内脏高敏感性正常化。
嗜酸乳杆菌通过诱导阿片样物质和大麻素受体对肠痛有镇痛作用。
此外,两项研究支持婴儿双歧杆菌特定菌株在肠易激综合征背景下的抗伤害感受性作用。
其他神经精神症状
微生物学与其他神经精神疾病有关,其中经常出现免疫和非免疫原因的混合。绿色荧光动物表现出有缺陷的记忆和认知能力。用小鼠菌群对GF小鼠进行再定殖可以增强或减少探索行为。海马脑源性神经营养因子水平与探索行为呈正相关。
益生菌可以改善感染引起的记忆障碍和糖尿病引起的认知障碍。肠道微生物的饮食变化也调节小鼠的认知和学习行为。
总之,肠道菌群的研究对中枢神经系统疾病的诊断、预后和治疗具有重要意义。
主要参考文献
夏隆等(2017)中枢神经系统和肠道微生物群。手机。167: 915–932.
丛等(2016)早期生活经验和肠道微生物群:脑-肠道-微生物群信号系统。新生儿护理。15(5): 314–323.
Rolig等人(2017年)。肠道神经系统通过限制微生物群的组成来促进肠道健康。PLoS Biol。15(2): e2000689。
Logsdon AF等人(2018)肠道反应:血脑屏障如何连接微生物群和大脑。Exp Biol Med。243(2): 159–165.
王、王(2016)。肠道微生物群-大脑轴。129(19): 2373–2380.
维希等(2008)过敏和胃肠系统。临床试验免疫153:3–6
Hooper LV等人(2012年)微生物群和免疫系统之间的相互作用。科学。336:1268–1273
Mowat AM。(2003)肠抗原耐受和免疫的解剖学基础。Nat Rev免疫。3:331–341.
布莱恩·柳等(2018)《肠道网络:肠道免疫和神经系统之间的相互作用》。免疫力。46(6): 910–926.
约翰逊·梅夫等人(2016年)肠粘液和粘蛋白的免疫学方面。Nat Rev免疫。16:639–649.
Gerbe F等人(2016年)肠上皮簇细胞启动对蠕虫寄生虫的2型粘膜免疫。自然。529:226–230.
Howitt磁共振等人(2016年)毛束细胞,味觉化学感觉细胞,在肠道中协调寄生虫2型免疫。科学。351:1329–1333.
Shivani Ghaisas等人(2016年)《健康和疾病中的肠道微生物群:在系统性和神经退行性疾病的发病机制中连接微生物群-肠道-大脑轴和环境因素》。药理疗法。158: 52–62.
Yatsunenko等人(2012年)从年龄和地理角度看人类肠道微生物群。自然。486:222–227.
多格拉等人(2015年)婴儿肠道微生物群的动态受分娩方式和妊娠期的影响,并与随后的肥胖有关。MBio。6
Villaran RF等(2010)溃疡性结肠炎加重脂多糖诱导的黑质多巴胺能系统损伤:帕金森病的潜在危险因素。j神经化学。114:1687–1700.
王Y,卡斯珀LH。(2014)微生物群在中枢神经系统疾病中的作用。Brain Behav Immun。38: 1–12.
迈耶等人(2017)肠道及其微生物群与中枢神经系统功能和心理健康:心身医学特刊介绍。精神医学。79(8): 844–846.
克莱恩·JF等人(2012年)。改变思维的微生物:肠道微生物群对大脑和行为的影响。自然评论。神经科学。13:701–712.
纳伊克(2013)通过评论对组织免疫进行条块分割和系统控制。自然免疫学。14:646–653.
克纳塞尔等人(2014年)母体免疫激活和中枢神经系统疾病的异常大脑发育。Nat Rev Neurol。10:643–660.
M hle L等(2016) Ly6Chi单核细胞提供了抗生物诱导的肠道微生物群变化和成年海马神经元发生之间的联系。细胞代表15:1945–1956。
马特科维奇-纳坦等人(2016)小胶质细胞的发育遵循一个调节大脑稳态的程序。科学
Desbonnet L .等人(2015年)小鼠早期衰老引起的肠道微生物群衰竭:对大脑和行为的影响。Brain Behav Immun。48:165–173.
谷和健康是谷和面向健康领域的品牌。通过无创采集微量粪便样本,常温下快递运输至古河检测中心。经过全自动的样品处理和提取,大规模高通量测序获得细菌菌群基因数据,并对其进行分析和解释。凭借世界领先的样本积累和行业独特的人工智能算法,实现基于肠道菌群的疾病预测和系统健康风险评估,以及包括肠道菌群、病原体感染、重金属污染以及营养和激素代谢水平在内的综合健康风险预警,提供准确、个性化的健康管理方案。公司成立于2012年,总部位于杭州,拥有优秀的R&D团队和独立的实验室。经过多年积累,已检测近6万份临床肠道菌群样本,建立了20多万种人群样本数据库。古和健康——让你和你的家人更健康。
1.《神经系统治疗 抑郁,自闭等神经系统疾病治疗新出路》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《神经系统治疗 抑郁,自闭等神经系统疾病治疗新出路》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/fangchan/1606624.html