什么是mRNA疫苗?
1990年,科学家将信使核糖核酸(信使核糖核酸——在体外转录的核糖核酸)注射到小鼠体内,发现它可以在小鼠体内表达活性,并以剂量依赖的方式产生相关蛋白质。这种直接注射mRNA的方法,通过表达特异性蛋白,可以产生免疫反应,是mRNA治疗的雏形。
在随后的研究中,虽然动物实验表明,基因可以起到类似疫苗的作用,达到治疗的目的。然而,由于当时的技术限制,在基因稳定性、药物输送和安全性方面存在瓶颈。这种疗法逐渐冷淡,更多的研究者转向DNA和替代蛋白领域。
21世纪,随着mRNA合成、修饰和递送技术的发展,mRNA治疗又回到了生物制药公司。与传统疫苗相比,mRNA在安全性上更具优势,不需要插入基因突变即可被正常细胞降解,其半衰期可通过调整序列修饰和递送载体来改变(图2)。更重要的是,传统疫苗对许多新病毒无能为力,更不用说对人类健康构成严重威胁的癌症了。mRNA的作用机制使其像一张膳食图。只要你编好RNA序列,就可以把细胞变成一个小药厂,mRNA引导细胞自行产生特定的蛋白质,发挥其全身功效。

传统疫苗、基因疫苗和基因疫苗的一些区别
mRNA疫苗靠什么?
作用机理MRNA参与DNA翻译和蛋白质生产的中间步骤。目前用于制作疫苗的RNA有两种,非复制型)mRNA和自扩增型)mRNA。传统的mRNA疫苗编码的抗原含有5个和3个非翻译区(UTRs),而自扩增RNA不仅可以编码抗原,还具有类似病毒复制过程的序列,使其可以在细胞内复制,增加蛋白质表达。
简而言之,RNA体外转录利用DNA模板和RNA聚合酶,包括T7、T3或Sp6噬菌体聚合酶,制备具有蛋白质编码功能的开放阅读框。这个阅读框架的两个重要组成部分是5’端的“帽子”结构和带有聚a的“尾巴”,另外还有一个非翻译区,可以提高复合体在转录过程中的稳定性,使人工制造的mRNA可以像成熟的mRNA分子一样起到转录组装的作用。裸mRNA很容易被胞外核糖核酸酶降解,所以用了很多载体来提高mRNA的摄取。mRNA一旦进入细胞质,细胞翻译机制就可以在其指导下组装氨基酸序列,进行翻译后修饰,适当折叠形成功能蛋白。mRNA的这些药理特性使其在疫苗治疗中具有无可比拟的优势。
新的技术近年来,不同的基因疫苗平台在免疫原性和疗效方面取得了很大进展。RNA序列工程技术使合成的mRNA具有比以前更好的翻译功能。高效低毒载体可以显著提高抗原在体内的表达。一些疫苗还添加了新的佐剂。
1.优化基因的翻译和稳定性
现有的mRNA修饰技术可以直接或间接影响免疫反应,主要包括:合成“帽子”样结构;在5’和3’UTR区域添加可控序列;修改poly A的“尾巴”。其中,5’和3’UTR序列的改进对提高基因和蛋白质表达的稳定性非常重要。选择与tRNA同源的密码子可以提高mRNA的翻译能力。分离和纯化技术也可以用来优化基因的生产。
2.免疫原性的调节
图3显示了树突细胞(DC)对两种基因疫苗的免疫反应。外源性mRNA可以在体内产生免疫刺激,因为它可以被细胞表面、内体或细胞质上的免疫应答受体识别。根据治疗方法的不同,这种免疫刺激也有优缺点。优点是可以带动DC成熟因子,进而刺激T细胞和B细胞产生强烈的免疫反应。缺点是,这种免疫诱导也可能抑制抗原的表达,对免疫反应产生负面影响。背后的复杂机制不是很清楚,但近年来有所进展。

基因疫苗引发免疫反应过程。黄色组代表RNA传感器,红色组代表抗原,绿色组代表DC成熟因子,红色和蓝色组代表MHC。图片右上方有一个脂质纳米粒载体
发现这种对mRNA的免疫刺激可以通过制备和纯化、引入修饰的核苷或改变载体分子来改善。mRNA疫苗生产过程中的酶促反应会产生一些双键RNA的副产物,因为双键RNA是一种潜在的病原体相关分子(PAMP),可以被许多细胞间隔区受体诱导,最终导致翻译抑制和mRNA降解。通过分析手段纯化制备的基因可以减少双链副产物,防止不必要的免疫刺激。除了双链RNA杂质的影响,单链RNA本身就是一种PAMP,可以引起I型干扰素的产生,引入天然核苷可以减少I型干扰素的产生。这些结果表明,纯化和修饰的基因可以明显提高蛋白质在树突状细胞中的表达。但有研究表明,纯化后,未修饰的mRNA在HeLa细胞中比修饰的mRNA能产生更多的蛋白质,这与上述结果相反。结论是,无论采用纯化还是修饰,都应该根据不同的靶细胞采取不同的组合策略和调控技术,只有这样才能发挥最佳疗效。
3.基因传递方式的研究进展
如上所述,裸mRNA在直接进入体内时会发生降解,因此高效的mRNA传递是疫苗效力的保证。目前生产中使用的是矢量和直喷。
(1)用载体将基因注入体内
常用的载体包括树突状细胞、鱼精蛋白、微sma载体和聚合物载体。树突状细胞是免疫系统中最有潜力的抗原表达细胞。阳离子多肽鱼精蛋白已被证明能保护基因不被核糖核苷酶降解。但与此同时,有数据表明,它可以降低蛋白质的表达,这可能是由于mRNA与鱼精蛋白之间的紧密联系造成的。阳离子脂质体和树枝状大分子等大分子在过去几年中被广泛应用于mRNA递送途径,这也是小干扰RNA (siRNA)领域的一大发展。脂质纳米粒载体已成为基因疫苗最常用的载体之一。
(2)基因直接注入人体
常用皮内注射或节内注射。有报道称,反复的节内接种mRNA可以刺激肿瘤相关抗原的T细胞反应,从而提高患者的无进展生存期(PFS)。
(3)实物交割方式
除了以上两种方法,还有物理方法的mRNA细胞膜渗透。如电基因枪、电穿孔等。物理方法的缺点是可能导致细胞死亡。
mRNA疫苗能带来什么?
目前,mRNA疫苗主要有两大应用领域,传染病和癌症(图4)。给药后应注意mRNA的生物分布。比如静脉给药后,载有mRNA的脂质纳米粒主要分布在肝脏,对于树突状细胞的激活并不理想。给药后影响生物分布的因素包括载体与基因的比例、净电荷等。比如带正电荷的纳米粒子主要针对肺,带负电荷的纳米粒子主要针对次级淋巴组织和骨髓。

目前临床研究阶段的基因疫苗疾病分布
抗传染病的mRNA疫苗开发针对传染性病原体的预防性或治疗性疫苗是遏制和预防流行病的最有效手段。然而,过去的疫苗产品不能对抗像艾滋病毒、疱疹病毒或呼吸道合胞病毒这样对人类健康造成巨大危害的病毒。此外,传统疫苗不能用于2014年至2016年爆发的埃博拉病毒和塞卡病毒等突发病毒性疾病。因此,迫切需要开发更有效的疫苗。
许多临床前动物实验已经证明了抗传染性病毒的基因疫苗的功效。它在动物实验中具有良好的安全性,其快速制备也适用于对传染病暴发的灵活反应。相对简单的生产工艺也便于质量控制。与蛋白质免疫不同,mRNA疫苗可以诱导强烈的CD4+或CD8+ T细胞反应。它们也不同于DNA免疫。在动物中,基因疫苗可以通过一两次低剂量疫苗接种产生抗体。目前,临床阶段开发的基因疫苗针对的疾病包括艾滋病毒、流感病毒和狂犬病病毒。
抗肿瘤的mRNA疫苗肿瘤疫苗和其他免疫疗法被认为是非常有前途的治疗恶性肿瘤的方法。肿瘤疫苗可以设计成靶向肿瘤细胞选择性表达的相关抗原,如生长因子。还可以靶向恶性肿瘤细胞突变产生的特异性抗原。针对癌症的mRNA疫苗一般起治疗作用,而不是传统的预防作用,目的是促进细胞介导的反应,如典型的T淋巴细胞反应,从而消除或减少肿瘤细胞。一些研发管道见图5。
1.基于树突状细胞的基因肿瘤疫苗
从1996年研究人员证明负载mRNA的树突状细胞可以刺激肿瘤抗原的免疫应答开始,相关的临床研究已经涵盖了转移性前列腺癌、肺癌、肾细胞癌、脑癌、黑色素瘤、急性髓细胞白血病、胰腺癌等。目前,研究人员还将负载树突状细胞的基因疫苗与传统的化疗药物或免疫检查点抑制剂相结合。在一项临床试验中,ⅲ-ⅳ期黑色素瘤患者同时接受单克隆抗体Ipilimumab和携带黑色素瘤抗原相关基因的树突状细胞注射。结果表明,这种疗法可以持续减少一些复发或难治性黑色素瘤患者的肿瘤。
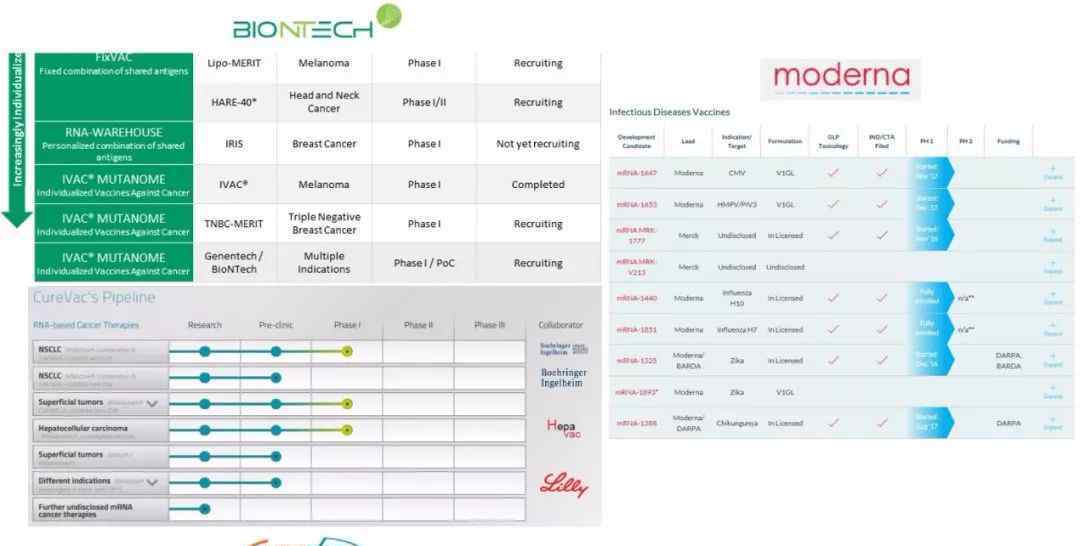
生物技术公司、科瑞瓦茨公司和现代公司的部分基因研发管道
2.基因肿瘤疫苗的直接注射
直接注射的给药途径包括皮内注射、肌内注射、皮下注射和鼻内给药,一些非传统方法包括结内注射、静脉给药、脾给药和肿瘤给药。不同的给药方式对基因疫苗的效果有很大的影响。一般来说,因为裸mRNA容易降解,血清蛋白聚合,所以不常用直接注射。
声明:我们尊重每一位原创作者的辛苦,文章的作者和出处在转载中注明。如果涉及版权问题,请联系我们。我们会尽快处理。
九友资本目前专注于人工智能、新一代通信技术、新材料、先进制造;投资原创新药、精密医学等领域。九优投资案例代表:优碧轩(人形机器人)、寒武纪(人工智能深度学习AI芯片)、中兴科技(智能安全、SVAC国标参与)、京东数字科技(数字金融、智慧城市)、天一尚佳(高铁刹车核心供货)、田冰科技(新航天动力、商用火箭);索源生物(精密医学、原创新药研发)、斯里兰卡微生物(m-RNA新药研发)、鼎航医药(精密医学、肿瘤免疫治疗创新药物研发)。
1.《mrna 三个方面了解mRNA是什么?》援引自互联网,旨在传递更多网络信息知识,仅代表作者本人观点,与本网站无关,侵删请联系页脚下方联系方式。
2.《mrna 三个方面了解mRNA是什么?》仅供读者参考,本网站未对该内容进行证实,对其原创性、真实性、完整性、及时性不作任何保证。
3.文章转载时请保留本站内容来源地址,https://www.lu-xu.com/guonei/671179.html




